Атенюація
Із використанням сигналів термінації пов’язана також система атенюації (attenuation – послаблення), яка використовується, зокрема, для регуляції активності триптофанового оперона (trp-оперона) E. coli. Оперон містить 5 структурних генів, що відповідають за синтез амінокислоти Trp, перед ними знаходяться промотор, оператор і лідерна послідовність, з якої розпочинається транскрипція (рис. 17, а).
Атенюація використовує ту обставину, що прокаріотична транскрипція тісно пов’язана з трансляцією. Лідерна частина РНК містить стартовий кодон, що впізнається рибосомою, і чотири елементи послідовності: ділянка 1 містить два сусідні триптофанові кодони, ділянки 2 – 3 і 3 – 4 є попарно комплементарними, за ділянкою 4 розташована оліго-U послідовність (рис. 17, б). Отже, шпилька 3 – 4, фланкована оліго-U, є сигналом термінації транскрипції. Коли концентрація Trp є низькою (є потреба в Trp і оперон має бути активним), рибосома зупиняється на триптофанових кодонах ділянки 1 (оскільки відсутня й триптофанілт-РНК). У цьому випадку утворюється шпилька 2 – 3 (ділянка 3 не залучається до утворення термінуючої шпильки), і РНК полімераза продовжує синтез повноцінної мРНК.
Рибосоми зв’язуються зі стартовими кодонами, що відповідають структурним генам, і синтезуються відповідні білки. У разі високого рівня Trp рибосома швидко проходить через ділянку 1 на ділянку 2 і зупиняється на стопкодоні. У результаті утворюється шпилька 3 – 4 – формується сигнал термінації, РНК-полімераза зупиняє транскрипцію після синтезу короткої нефункціональної лідерної РНК.
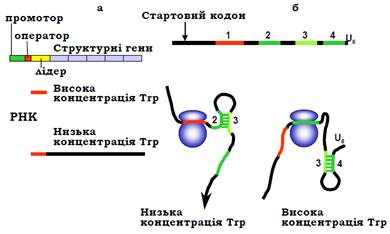
Рис. 5.17. (а): Схема trp-оперона, на якому синтезуються два РНК-продукти залежно від внутрішньоклітинної концентрації Trp. (б): Лідерна РНК і два варіанти спарювання основ у її складі залежно від розташування рибосоми.
trp-Оперон перебуває також під контролем trp-репресора. Алостеричним регулятором репресора є сам Trp: у комплексі з ним репресор набуває конформаційної форми, що має високу спорідненість до оператора. При зниженні концентрації Trp репресор дисоціює й ефективність ініціації транскрипції підвищується в ~70 разів. Атенюація є додатковим, менш ефективним механізмом регуляції: ефективність транскрипції підвищується в ~10 разів у відсутності Trp за рахунок атенюації (у присутності Trp ~10 % РНК-полімераз долають сигнал термінації й продовжують працювати, у разі відсутності Trp – практично всі). Сумісна дія атенюації та негативного контролю за рахунок репресора дозволяє змінювати активність оперона в ~700 разів залежно від внутрішньоклітинної концентрації Trp.
Регуляція транскрипції бактеріофага λ
Після проникнення в бактеріальну клітину лінійна ДНК бактеріофага λ (довжиною приблизно 50 тис. пар основ) замикається в кільце бактеріальною лігазою (ligase – АТР-залежний фермент, що каталізує утворення фосфодіефірного зв’язку між 5′- та 3′-кінцевими нуклеотидами). Геном фага містить гени, що відповідають за синтез білків головки та хвоста фагової частинки, реплікацію фагової ДНК, лізис бактерії, рекомбінацію (вбудовування фагової ДНК у бактеріальний геном), і кілька регуляторних генів, що кодують фактори транскрипції (рис. 18).
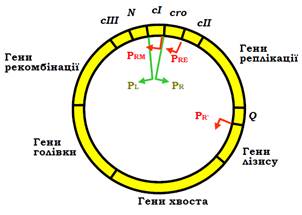
Рис. 18. Циркулярна ДНК бактеріофага λ. Стрілочками позначено промотори та напрямок транскрипції: зелені – сильні промотори, червоні – такі, що потребують активації.
Існують два шляхи розвитку фага: лізогенія – лінеаризація фагової ДНК, вбудовування її в бактеріальний геном і блокування більшості генів фага; лізис (після інфекції або шляхом вирізання фагової ДНК із бактеріального геному та її циркуляризації після лізогенії) – активація реплікації фагової ДНК і синтезу білків оболонки, збирання фагових частинок та руйнування клітини.
Ключову роль у виборі одного з двох шляхів виконують два фактори транскрипції: білок Cro і λ-репресор – продукти відповідно генів сro і сІ, що містяться поруч у фаговому геномі (рис. 18, 19). Відразу після інфекції РНК-полімераза зв’язується з двома сильними промоторами PR і PL (рис. 18), з яких відбувається транскрипція у протилежних напрямах на генах сro і N відповідно. Обидва гени закінчуються термінаторами, але щойно з’являється білок N, він зв’язується з транскриптами, рекрутує декілька бактеріальних білків, і цей комплекс запобігає впізнанню термінаторів (за механізмом антитермінації, див. рис. 16, а). РНК-полімераза в цьому випадку продовжує синтезувати поліцистронну мРНК на сІІІ і генах рекомбінації (із промотора PL) і сІІ, генах реплікації та Q (із промотора PR). Після цього можливе розгалуження на два альтернативні шляхи (рис. 20).
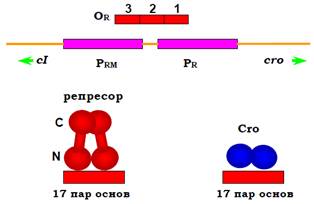
Рис. 19. Зона контакту між генами сІ і cro фага λ: промотори генів частково перекривають три оператори OR1,2,3, кожен з яких має спорідненість до репресора та білка Cro.
Розглянемо спочатку шлях лізогенії. Продукт гена сІІ – активатор транскрипції, який забезпечує зв’язування РНК-полімерази зі слабким промотором PRЕ. Із цього промотора (у напрямку, протилежному напрямку транскрипції сro, рис. 18) транскрибується ген сІ, унаслідок чого з’являється λ-репресор. Крім того, білок сІІ активує ген інтегрази (міститься серед генів рекомбінації) – ферменту, що забезпечує вбудовування фагової ДНК у геном клітини-хазяїна. Продукт гена сІІІ захищає білок сІІ від бактеріальних протеаз, тобто підвищує час життя активатора. Отже, за умови високої концентрації сІІ виникає певна кількість λ-репресора, а фагова ДНК вбудовується інтегразою в бактеріальний геном. Репресор (гомодимер, N-кінцеві частини обох субодиниць взаємодіють з ДНК має спорідненість до двох наборів операторів. Один із цих наборів – оператори OR 1,2,3, кожен довжиною 17 пар основ – частково перекриває промотори PR і PRM (рис. 19).
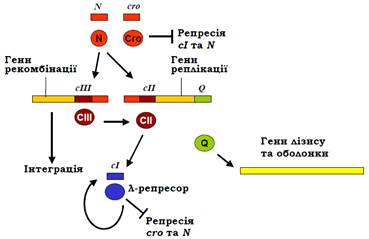
Рис. 5.20. Мережа регуляторних взаємодій між генами фага λ. Прямокутники – транскрипти, отримані з відповідних генів, овали – їхні білкові продукти.
Промотор PRM є слабким і може використовуватись для транскрипції гена сІ тільки за умови активації. Послідовності операторів є гомологічними одна одній і розрізняються за спорідненістю до репресора – найвищу спорідненість має ділянка OR1. При заповненні цього оператора репресором промотор PR гена сro та всіх генів праворуч від нього є заблокованим. С-кінцеві частини двох димерів репресора здатні до взаємодії: за наявності репресора в сайті OR1 швидко заповнюється також сайт OR2. Інакше кажучи, репресор кооперативно взаємодіє з ділянками OR1,2: його зв’язування з ДНК підсилюється білок-білковими взаємодіями димерів. При заповненні оператора OR2 репресор (який є негативним регулятором гена cro) спрацьовує як позитивний регулятор свого власного гена сІ – індукує зв’язування РНК-полімерази з промотором PRM. Спорідненість репресора до оператора OR3 є найнижчою: ця ділянка некооперативно заповнюється при зростанні концентрації репресора, унаслідок чого відбувається блокування гена сІ.
Таким чином активність гена сІ і концентрація репресора підтримуються на оптимальному рівні за принципом зворотного зв’язку. На стадії лізогенії тільки ген сІ є активним – репресор блокує також промотор PL (через відповідні оператори ОL), тобто транскрипцію всіх генів ліворуч від N.
Якщо бактерія піддається дії мутагенів, коли виникає ризик загибелі клітини (разом із вбудованою фаговою ДНК), відбувається активація певної бактеріальної протеази, яка розрізає молекулу репресора між її N- та С-кінцевими доменами. Результатом є порушення димеризації мономерів репресора і втрата спорідненості до ДНК. Унаслідок звільнення операторів OR та OL РНК-полімераза зв’язується з промоторами PR та PL і починає транскрибувати гени cro та N. Тобто знову виникає ситуація, що спостерігається відразу після інфекції – спрацьовують гени реплікації, сІІ і Q. Але при цьому білок сІІ швидко деградується протеазами, не встигаючи активувати синтез репресора. Така сама ситуація (висока активність протеаз) може реалізуватися відразу після інфекції за умови збагачення середовища на харчові ресурси.
Білок Cro (також гомодимер) некооперативно взаємодіє з операторами OR1,2,3, спорідненість до яких знижується в порядку 3–2–1.
Заповнення OR3 білком Cro остаточно вимикає синтез реп ресора з промотора PRM. Подальше заповнення операторів при зростанні концентрації Cro вимикає транскрипцію cro і генів праворуч від нього, так само як і генів ліворуч від N за рахунок зв’язування Cro з операторами OL. Але головний наслідок активності cro полягає в появі білка Q. Ще один промотор PR’ є насправді сильним, але відразу за ним розташований термінатор – РНК-полімераза за відсутності Q синтезує з цього промотора короткий нефункціональний транскрипт. Білок Q спрацьовує як антитермінатор (за механізмом, зображеним на рис. 16, б), забезпечуючи долання цього бар’єра. У результаті відбувається синтез поліцистронної мРНК на генах лізису та білків оболонки (праворуч від Q), і відбувається лізис клітини з виходом фагових частинок.
Розглянута досить складна система регуляції транскрипції порівняно простого геному бактеріофага λ дає уявлення про те, наскільки ускладнюється загальна система регуляції транскрипції у бактерій і тим більше – в еукаріотів. Насправді ж складність загальних систем внутрішньоклітинної регуляції, які залежать від тонкого балансу великої кількості різноманітних впливів, залишається дуже далекою від остаточного розуміння.
Дата добавления: 2015-09-11; просмотров: 1762;
