Робота № 7/2. Вивчення швидкості реакції йодування ацетону
Мета роботи. Визначити середню константу швидкості, енергію активації та температурний коефіцієнт швидкості реакції.
Методика роботи. Йодування ацетону відбувається за реакцією:
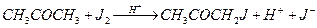
Процес протікає автокаталітично, його прискорює один із продуктів реакції - йони водню. За відсутності йонів водню (у нейтральному розведеному водному розчині) процес протікає досить повільно. Йодування ацетону проходить у дві стадії:
1. Оборотна реакція енолізації ацетону
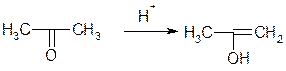
2. Взаємодія йоду з енольною формою
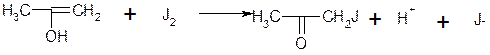
Перша реакція протікає повільно, друга - швидко і практично до кінця. Тому швидкість процесу в цілому визначається швидкістю енолізації ацетону і є пропорційною концентрації водневих іонів і ацетону відповідно до рівняння
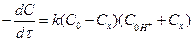 ; (1)
; (1)
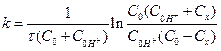 ,
,
де С0 - початкова концентрація ацетону; С0H+ - початкова концентрація іонів водню; Сх - різниця між початковою концентрацією ацетону і концентрацією ацетону на час t (зменшення концентрації ацетону); х - час від початку реакції. Протікання реакції контролюється за даними аналізу проб, що періодично відбираються з реакційної суміші, або за оптичною густиною, яка вимірюється за допомогою фотоелектроколориметра.
Порядок роботи. Встановити термостат на задану температуру. У мірну колбу об'ємом 250 мл налити 25 мл 0,1 н розчину йоду у 4%-ному розчині KJ, долити 25 мл НС1 (концентрація кислоти задається викладачем) і воду до об'єму нижче позначки приблизно на 25-30 мл. Далі в колбу з реакційною сумішшю додати 2-г ацетону (наважку брати на аналітичних терезах у закритому бюксі) або 25 мл 1 н водного розчину ацетону. Момент вливання ацетону відмітити за годинником. Після вливання ацетону об'єм розчину в колбі швидко довести до мітки дистильованою водою, ретельно перемішати і відразу відібрати піпеткою 10 мл проби, відмічаючи цей момент за годинником.
За початок реакції ( 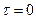 ) прийняти час вливання ацетону в реакційну суміш. Колбу з реакційною сумішшю закрити корком (для запобігання випаровування ацетону). Відібрану пробу помістити в стакан для титрування, в якому міститься 25 мл 0,1 н розчину NaНСО3. Вміст йоду визначити титруванням 0,01 н. розчином Na2S2Оз у присутності крохмалю. За ходом реакції слідкувати за результатами аналізу проб, які відбирати через певні інтервали часу. Для одержання надійних результатів брати не менше семи-восьми проб. Другу пробу відібрати через 10 хв після першої. За результатом перших двох титрувань встановити, через який інтервал часу належить брати проби. Цей інтервал визначається так, щоб витрата розчину гіпосульфіту натрію на кожну наступну пробу зменшувалась на 1-3 мл. Залежно від того, як проходить реакція, час між послідовним відбиранням проб необхідно поступово збільшувати (наприклад, перші три титрування проводять через 10 хв, потім два - через 15 хв, ще два - через 20 хв і одне титрування - через 25 хв). Чим вищою є температура, за якої проводять дослід, тим більшим є вміст кислоти в реакційній суміші, тим частіше слід відбирати проби. Під час відбору проб колбу з термостату не виймають. Результати вимірювань заносять у таблицю.
) прийняти час вливання ацетону в реакційну суміш. Колбу з реакційною сумішшю закрити корком (для запобігання випаровування ацетону). Відібрану пробу помістити в стакан для титрування, в якому міститься 25 мл 0,1 н розчину NaНСО3. Вміст йоду визначити титруванням 0,01 н. розчином Na2S2Оз у присутності крохмалю. За ходом реакції слідкувати за результатами аналізу проб, які відбирати через певні інтервали часу. Для одержання надійних результатів брати не менше семи-восьми проб. Другу пробу відібрати через 10 хв після першої. За результатом перших двох титрувань встановити, через який інтервал часу належить брати проби. Цей інтервал визначається так, щоб витрата розчину гіпосульфіту натрію на кожну наступну пробу зменшувалась на 1-3 мл. Залежно від того, як проходить реакція, час між послідовним відбиранням проб необхідно поступово збільшувати (наприклад, перші три титрування проводять через 10 хв, потім два - через 15 хв, ще два - через 20 хв і одне титрування - через 25 хв). Чим вищою є температура, за якої проводять дослід, тим більшим є вміст кислоти в реакційній суміші, тим частіше слід відбирати проби. Під час відбору проб колбу з термостату не виймають. Результати вимірювань заносять у таблицю.
| Температура досліду, 0С=........ | Кількість 1 н HCl =….. | ||||||
| № | Час вимірювання (за годинником) | Час від початку реакції, хв. | Об'єм 0,01 н. розчину Na2S2O3, мл | C0 ацетону, моль/л | С0H+, моль/л | Cx, моль/л | k |
Концентрацію ацетону, який прореагував за певний проміжок часу, обчислити за рівнянням
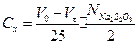 , (2)
, (2)
де Vt - кількість 0,01 н Na2S2O3, витрачена на титрування проби, мл; Vо - кількість 0,01 н Na2S2O3, яка повинна була витратитись у момент початку реакції, мл; N - нормальність розчину Na2S2O3.
Значення V0 на практиці визначити не вдається, тому що від моменту вливання ацетону до моменту визначення проби проходить певний час. Тому V0 визначають за допомогою графіка. Для цього будують графік у координатах V - t та екстраполяцією одержаної прямої на 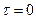 визначають V0.
визначають V0.
Використовуючи рівняння (2) та значення С0, С0H+, Сх, t, визначити k за різних температур. За допомогою цих даних побудувати графік у координатах 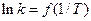 і обчислити методом найменших квадратів температурний коефіцієнт та енергію активації (значення k за різних температур можна взяти з довідника).
і обчислити методом найменших квадратів температурний коефіцієнт та енергію активації (значення k за різних температур можна взяти з довідника).
Література: [21, с. 217-225, 231-233, 257-260; 24, с. 322-354, 362; 25, с. 195-206, 217; 22, с. 319-345; 23, с. 182-192, 198, 199].
Дата добавления: 2015-09-11; просмотров: 801;
