Робота № 7/1. Визначити константу швидкості реакції гідратації оцтового ангідриду
Мета роботи. Визначити середню константу швидкості реакції.
Методика роботи. У роботі використовують один з електрохімічних методів аналізу для вивчення кінетики реакції:
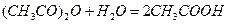 .
.
Ця реакція в розведених водних розчинах проходить як реакція 1-го порядку і практично до кінця. До найбільш зручних методів відноситься метод вимірювання електропровідності під час протікання реакції. Електропровідність системи з часом значно підвищується завдяки утворенню оцтової кислоти.
Концентрацію оцтової кислоти, що утворюється, визначають за величиною електропровідності розчину, яку вимірюють за допомогою містка Кольрауша. Опір розчину Rt визначається за рівнянням
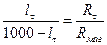 , (1)
, (1)
де Rмаг - опір магазину; lt і (1000 - lt) - довжина плеч реохорду (мм) (див. рисунок до роботи № 10/1).
Якщо позначити електропровідність розчину на момент початку реакції як к0, електропровідність на даний момент часу кt, електропровідність у кінці реакції кµ (коли вона не змінюється), тоді
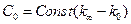 ;
;
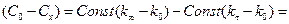
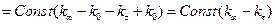 ; (2)
; (2)
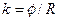 , (3)
, (3)
де j - стала посудини.
Константа швидкості реакції 1-го порядку розраховується за рівнянням
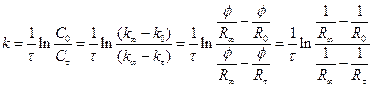 . (4)
. (4)
Опір розчину на момент початку реакції (R0) експериментально не вимірюється, тому що від початку реакції до першого вимірювання проходить певний час. Тому ln(1/Rµ - 1/R0) визначають екстраполяцією, для чого будують графік 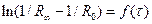 .
.
Дата добавления: 2015-09-11; просмотров: 673;
