Взаємодія між молекулами.
Між молекулами завжди діють сили електростатичного походження. Результат міжмолекулярної взаємодії полягає тільки в притяганні молекул.
Сили міжмолекулярної взаємодії Ван-дер-Ваальса поділяють:
1. Орієнтаційна. Виникає між полярними молекулами, які мають сталі електричні моменти диполів

Енергія орієнтаційної взаємодії залежить від величин дипольних моментів молекул, відстані між ними та температури.
Для однакових полярних молекул
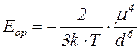
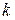 - константа Больцмана;
- константа Больцмана;
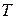 - абсолютна температура;
- абсолютна температура;
 - електричний момент диполя;
- електричний момент диполя;
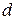 - відстань між центрами диполів.
- відстань між центрами диполів.
Уразі взаємодії різних полярних молекул  і
і 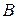
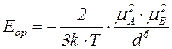
Знак "-" означає, що результатом міжмолекулярної взаємодії є притягання молекул, що спричинює зниження енергії системи.
Зі збільшенням дипольного моменту енергія орієнтаційної взаємодії збільшується, отже збільшується температура кипіння.
2. Індукційна. Для речовин з полярними молекулами індукційна взаємодія додається до орієнтаційної і дещо підсилює міжмолекулярне притягання.
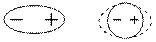
Якщо взаємодіють полярні і неполярні молекули. То під впливом електричного поля, що створюється полярними молекулами, неполярні молекули можуть поляризуватися і набувати індукованих дипольних моментів.
Енергія індукційної взаємодії посилюється з підвищенням здатності молекул до поляризації і послаблюється зі зростанням відстані між молекулами. Вона не залежить від температури.
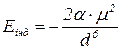
 - коефіцієнт здатності до поляризації;
- коефіцієнт здатності до поляризації;
 - момент наведеного (індукованого) диполя;
- момент наведеного (індукованого) диполя;
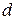 - відстань між молекулами з наведеними диполями, що взаємодіють.
- відстань між молекулами з наведеними диполями, що взаємодіють.
3. Дисперсійна. Зумовлена виникненням миттєвих диполів внаслідок зміщення електронних оболонок, що перебувають у постійному русі, відносно ядер.
Енергія дисперсійної взаємодії посилюється з підвищенням здатності молекул до поляризації і послаблюється зі зростанням відстані між молекулами.
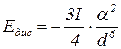
 - коефіцієнт здатності до поляризації;
- коефіцієнт здатності до поляризації;
 - енергія іонізації молекули.
- енергія іонізації молекули.
Дисперсійна взаємодія є універсальною. Вона виникає між будь-якими молекулами незалежно від їх будови.
Дата добавления: 2015-09-02; просмотров: 1174;
