Металлургия магния
Магний – легкий металл плотностью 1,74 г/см³, температура плавления – 651 ºC, решетка гексагональная. Окисляется на воздухе, образуя окисную пленку, предохраняющую его от дальнейшего окисления. Обладает также большим сродством к хлору. Сплавы на основе магния легки, прочны, применяются в машиностроении и приборостроении. Основным сырьем для получения магния является карналлит (MgCl2·KCl·6H2O), магнезит (MgCO3), доломит (MgCO3·CaCO3), бишофит (MgCl2·6H2O). Последний насыщает морскую воду (1000 т морской воды содержит 1т магния). Металлический магний получают двумя способами: электролитическим и термическим. Наиболее распространен первый способ. При этом, как и для алюминия, электролизу подвергают расплав солей (основная составляющая MgCl2).
Подготовка руд состоит в следующем.
Магнезит и доломит подвергают механическому обогащению и обжигу при 850…950 0C:
MgCO3 →MgO+CO2; MgCO3·CaCO3 →MgO·CaO+CO2 .
Затем обоженную окись магния подвергают хлорированию в присутствии восстановителя – углерода: MgO+Cl2+C → MgCl2+CO .
Карналлит подвергают очистке от примесей, для чего измельченный карналлит обрабатывают горячей водой. При этом MgCl2 и KCl переходят в раствор, охлаждая который, получают кристаллы искусственного карналлита. Затем его обезвоживают и плавят в электропечах.
Электролитический способ получения Mg (электролиз MgCl2) состоит из следующих операций: загрузка электролита в ванны, извлечение магния, удаление отработанного электролита и шлама.
Для электролиза MgCl2 применяют плотно закрывающиеся ванны, так как при этом выделяется хлор [6, рис.33]. Ванна, футерованная шамотом, представляет собой ячейку, включающую угольный анод 1 и два катода в виде стальных пластин 3. В герметизированной ячейке анодное пространство отделено от катодного шамотной перегородкой 2 для сбора и отвода выделяющегося хлора. Таких ячеек в электролизере для получения Mg несколько. Электролитом служит расплав солей MgCl2, CaCl2, NaCl, KCl с добавкой NaF и CaF2. Электролиз ведут при 720 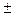 10 0C. Расход электроэнергии на получение 1т Mg составляет 15…17 тысяч кВт/ч.
10 0C. Расход электроэнергии на получение 1т Mg составляет 15…17 тысяч кВт/ч.
В процессе электролиза происходит разложение MgCl2. Образующиеся при этом ионы Mg разряжаются на катодных пластинах, собираются в капли и всплывают на поверхность электролита. Жидкий магний периодически удаляют вакуум ковшом. Хлор, после разряда ионов хлора на аноде, собирается над поверхностью электролита под перегородкой 2, откуда отсасывается через хлоропровод.
Окись магния, частично восстановленное железо и другие примеси электролита опускаются на дно в виде шлама 4.
Рафинирование магния. В электролизных ваннах получают черновой магний, содержащий до 5% примесей (Fe, Na, K, Ca, MgCl2, KCl, NaCl, CaCl2, MgO). Поэтому его подвергают переплавке с флюсами, содержащими хлориды Mg, Ba, K, Na и других. Переплавка осуществляется в электропечах при 720 0C в течение 0,5…1часа. Перемешивание расплава способствует растворению примесей во флюсе, всплыванию и переходу их в шлак. Чистота рафинированного Mg достигает 99,5…9,9%. Более глубокую очистку Mg можно осуществить путем его возгонки в вакууме, в реторте, нижняя часть которой подогревается, а верхняя охлаждается для конденсации паров Mg.
Термические способы получения магния разработаны в связи с дороговизной электролитического, получают широкое развитие вследствие безвредности производства и простоты.
1 Химико-термический способ основан на восстановлении Mg из MgO при помощи Si и Ca: MgO+CaO+Si→ CaO·SiO2+Mg. Процесс ведется при 1100…1200 0C в нержавеющих ретортах с кристаллизатором.
2 Карбидо-термический метод основан на восстановлении Mg из MgO при помощи карбида CaC2: MgO+CaC2→Mg+CaO+CO↑. Из MgO и CaC2 изготавливают брикеты, которые обжигают в ретортах (в вакууме) при 1100…1200 0C. Образующиеся при этом пары Mg кристаллизуются в кристаллизаторах.
3 Углетермический метод основан на восстановлении Mg углеродом:
MgO+C =Mg + CO при 2000 0C.
Дата добавления: 2015-09-11; просмотров: 2043;
