Плавление и кристаллизация металлов
При нагреве или охлаждении металла переход из одного состояния в другое происходит с возникновением или разрушением кристаллической решётки и сопровождается тепловым эффектом. Вследствие этого металлы переходят из одного состояния в другое при постоянных температурах, и на кривых охлаждения или нагрева наблюдаются температурные остановки (см. рис.1).
Тпл – температура плавления металла;
Ткр – температура кристаллизации металла.
1.1
Участки 1-2 и 4-5 – переход металла из одного состояния в другое.
В т.1 происходит разрушение кристаллической решётки. На участке 1-2 вся тепловая энергия идёт на её разрушение. Металл переходит из твёрдого состояния в жидкое – процесс плавления. При этом увеличивается объём металла на 2…6% за счёт увеличения расстояния между атомами, силы взаимодействия при этом между атомами гораздо меньше, чем в твёрдом металле.
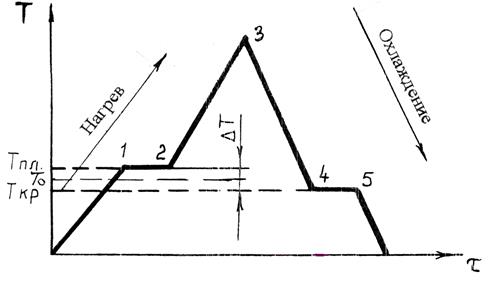
Рисунок 1
Для жидкости характерен ближний порядок, когда упорядоченное расположение атомов распространяется на небольшое расстояние. Этот порядок неустойчив. При температурах, близких к температуре плавления, в жидком металле наблюдаются области, в которых расположение атомов, близко к расположению атомов в твёрдом кристаллическом теле. Эти области называются фазовыми флуктуациями. Наиболее крупные флуктуации при определённых условиях могут стать зародышами кристаллов (центрами кристаллизации). Чтобы начался процесс кристаллизации необходимо переохладить металл ниже температуры плавления.
∆Т= Тпл -Ткр – тепловой гистерезис (несовпадение температуры плавления и температуры кристаллизации). Величина переохлаждения определяется природой металла, наличием примесей в металле, скоростью охлаждения (рис. 2). Если примесей мало, то металл надо значительно охладить.
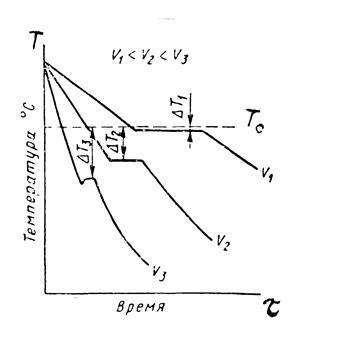
Рисунок 2
Переход металла из жидкого состояния в твёрдое (процесс кристаллизации) связан с возникновением кристаллической решётки. Этот процесс происходит при постоянной температуре, что обусловлено выделением скрытой теплоты кристаллизации (участок 4-5 на рис. 1).
1.5.1 Энергетические условия процесса кристаллизации
В природе все процессы идут в сторону уменьшения энергии системы. Состояние системы определяется особой функцией – свободной энергией.
F = U – TS,где
F – свободная энергия системы;
U – внутренняя энергия системы;
Т – температура;
S – энтропия.
С увеличением температуры свободная энергия жидкого Fж и твёрдого Fтв тела уменьшается (рис. 3).
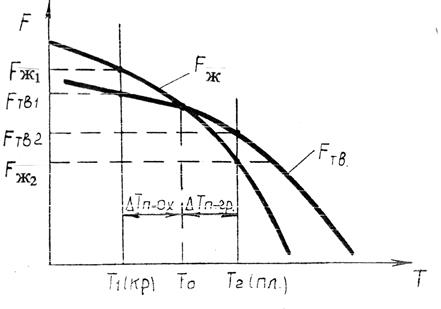
Рисунок 3
При Т0 Fтв = Fж – энергетически равноценны твёрдое и жидкое состояние вещества. Поэтому процессы плавления и кристаллизации происходить не будут (динамическое равновесие).
При Т1 Fтв1 < Fж1 – энергетически выгодно твердое состояние.
При Т2 Fж2 < Fтв2 – энергетически выгодно жидкое состояние.
Для начала кристаллизации вещество необходимо охладить ниже Т0, а для плавления нагреть выше Т0.
∆ Тпереохлажд.=Т0-Т1 – степень переохлаждения,
∆ Тперегрева.=Т2-Т0 – степень перегрева.
Дата добавления: 2015-09-11; просмотров: 4473;
