Изменение энтропии в обратимых и необратимых процессах
Изменение энтропии в обратимых процессах ds равно отношению изменения теплоты dq к температуре Т, при которой происходит это изменение и определяется по формуле
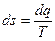 .
.
Это выражение справедливо для обратимого равновесного процесса. В реальных необратимых процессах часть работы против внешних сил затрачивается на преодоление внутреннего и внешнего трения и переходит в теплоту 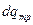
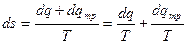 .
.
Тогда обобщенная формулировка второго закона термодинамики принимает вид
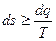
Знак «=» соответствует обратимым процессам.
Знак «>» соответствует необратимым процессам.
Для теплоизолированных систем, у которых dq = 0, формулировка второго закона термодинамики принимает вид
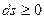 .
.
Самопроизвольные процессы в изолированной системе всегда приводят к возрастанию энтропии.
Это принцип возрастания энтропии. Самое устойчивое состояние системы – это состояние с максимальной энтропией.
Дата добавления: 2015-09-11; просмотров: 3817;
