Элементарное изменение энтропии dS (или ds) равно отношению изменения теплоты dQ (или dq) к температуре Т, при котором происходит это изменение.
Энтропия не зависит от характера процесса и определяется начальным и конечным состоянием системы 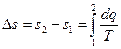 .
.
Подобно любой другой функции состояния энтропия может быть представлена в виде функции двух параметров состояния термодинамической системы.
Понятие энтропии позволяет ввести удобную для практических расчетов Т-s диаграмму, на которой состояние системы изображается точкой, а термодинамический процесс линией (рис. 1.10).
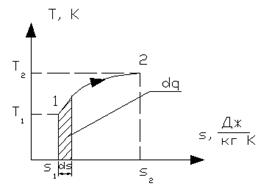
Рисунок 1.10 – Пример T-s диаграммы
Из уравнения 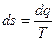 следует, что в равновесном процессе
следует, что в равновесном процессе
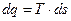 ;
;
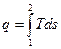 .
.
Очевидно, что в T-s диаграмме элементарная теплота процесса dq изображается площадкой с высотой Т и основанием ds (на рис. 1.10 она заштрихована), а площадь, ограниченная линией процесса 1-2, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса q.
В соответствии с формулой 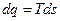 изменение энтропии ds и изменение теплоты dq имеют одинаковые знаки, следовательно по характеру изменения энтропии можно судить о направлении процесса теплообмена. При подводе теплоты (
изменение энтропии ds и изменение теплоты dq имеют одинаковые знаки, следовательно по характеру изменения энтропии можно судить о направлении процесса теплообмена. При подводе теплоты ( 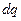 >0) к телу его энтропия возрастает (ds>0), а при отводе теплоты (
>0) к телу его энтропия возрастает (ds>0), а при отводе теплоты ( 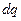 <0) энтропия убывает (ds<0).
<0) энтропия убывает (ds<0).
Дата добавления: 2015-09-11; просмотров: 1786;
