Клеточная (плазматическая) мембрана, ее основные функции
Клетки отделены от внутренней среды организма клеточной или плазматической мембраной. Мембрана обеспечивает: 1) избирательное проникновение в клетку и из нее молекул и ионов, необходимых для выполнения специфических функций клеток; 2) избира-
*В подготовке разделов 1.6-1.9 принимал участие проф.М.Б.Баскаков
тельный транспорт ионов через мембрану, поддерживая трансмембранную разницу электрического потенциала; 3) специфику межклеточных контактов.
Благодаря наличию в мембране многочисленных рецепторов, воспринимающих химические сигналы — гормоны, медиаторы и другие биологически активные вещества, она способна изменять метаболическую активность клетки. Мембраны обеспечивают специфику иммунных проявлений, благодаря наличию на них антигенов — структур, вызывающих образование антител, способных специфически связываться с этими антигенами.
Ядро и органеллы клетки также отделены от цитоплазмы мембранами, которые предупреждают свободное движение воды и растворенных в ней веществ из цитоплазмы в них и наоборот. Это создает условия для разделения биохимических процессов, протекающих в различных отсеках (компартментах) внутри клетки.
| Рис. 1.1 Организация мембраны. |
Структура мембраны клетки.Мембрана клетки — эластичная структура, толщиной от 7 до 11 нм (рис.1.1). Она состоит, в основном, из липидоа и белков. От 40 до 90% всех липидов составляют фосфолшшды- фосфатидилхолин, фосфатидилэтаноламин, фос-фатидилсерин, сфингомиелин и фосфатидилинозит. Важным компонентом мембраны являются гликолипиды, представленные церебро-зидами, сульфатидами, ганглиозидами и холестерином. Основной структурой мембраны клетки является двойной слой фосфолигшдных молекул. За счет гидрофобных взаимодействий углеводные цепочки липидных молекул удерживаются друг возле друга в вытянутом состоянии. Группы же фосфолипидных молекул обоих слоев взаимо действуют с белковыми молекулами, погруженными в липидную
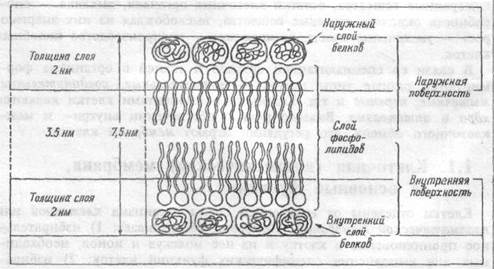
мембрану. Благодаря тому, что большинство липидных компонентов бислоя находится в жидком состоянии, мембрана обладает подвижностью, совершает волнообразные движения. Ее участки, а также белки, погруженные в липидный бислой, перемешаются из одной ее части в другую. Подвижность (текучесть) мембран клеток облегчает процессы транспорта веществ через мембрану.
Белки мембраны клеток представлены, в основном, гликопроте-инами. Различают интегральные белки, проникающие через всю толщу мембраны и периферические белки, прикрепленные только к поверхности мембраны, в основном, к внутренней ее части. Периферические белки почти все функционируют как энзимы (ацетилхоли-нестераза, кислая и шелочная фосфатазы и др.). Но некоторые энзимы также представлены интегральными белками — АТФ-аза. Интегральные белки обеспечивают селективный обмен ионов через каналы мембран между экстрацеллюлярной и интрацеллюлярной жидкостью, а также действуют как белки — переносчики крупных молекул. Рецепторы и антигены мембраны могут быть представлены как интегральными, так и периферическими белками. Белки, примыкающие к мембране с цитоплазматической стороны, относятся к цитоскелету клетки. Они могут прикрепляться к мембранным белкам. Так, белок полосы 3 (номер полосы при электрофорезе белков) эритроцитарных мембран объединяется в ансамбль с другими молекулами цитоскелета — спектрином через низкомолекулярный белок анкирин (рис. 1.2).
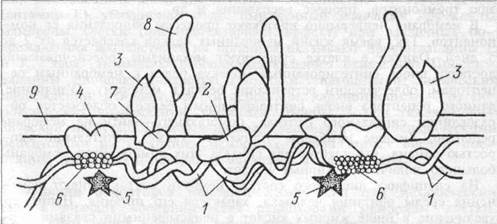
Рис. 1.2 Схема расположения белков в примембранном цитоскелете эритроцитов.
1 — спектрин; 2 — анкирин; 3 — белок полосы 3;
4 — белок полосы 4,1; 5 — белок полосы 4,9;
6 — олигомер актина; 7 — белок 6; 8 — гпикофорин А;
9 — мембрана.
Спектрин является основным белком цитоскелета, составляющим двумерную сеть, к которой прикрепляете—актин. Актин образует
микрофиламенты, представляющие собой сократительный аппарат ци-тоскелета. Цитоскелет позволяет клетке проявлять гибкоэластические свойства, обеспечивает дополнительную прочность мембраны. Большинство интегральных белков — гликопротеины. Их углеводная часть выступает из клеточной мембраны наружу. Многие гликопротеины обладают большим отрицательным зарядом из- за значительного содержания сиаловой кислоты (например, молекула гликофорина). Это обеспечивает поверхности большинства клеток отрицательный заряд, способствуя отталкиванию других отрицательно заряженных объектов. Углеводные выступы гликопротеинов являются носителями антигенов групп крови, других антигенных детерминант клетки, они действуют как рецепторы, связывающие гормоны. Гликопротеины образуют адгезивные молекулы, обуславливающие прикрепление клеток одна к другой, т.е. тесные межклеточные контакты.
Особенности обмена веществ в мембране.Мембранные компоненты подвержены многим метаболическим превращениям под влиянием ферментов, расположенных на их мембране или внутри ее. К ним относятся окислительные ферменты, играющие важную роль в модификации гидрофобных элементов мембран — холестерина и др. В мембранах же при активации ферментов — фосфолипаз происходит образование из арахидоновой кислоты биологически активных соединений — простагландинов и их производных. В результате активации метаболизма фосфолипидов вмембране образуются тром-боксаны, лейкотриены, оказывающие мощное воздействие на адгезию тромбоцитов, процесс воспаления и др.
В мембране непрерывно протекают процессы обновления ее компонентов. Так, время жизни мембранных белков колеблется от 2 до 5 дней. Однако в клетке существуют механизмы, обеспечивающие доставку вновь синтезированных молекул белка к мембранным рецепторам, облегчающим встраивание белка в мембрану. "Узнавание" данного рецептора вновь синтезированным белком облегчается образованием сигнального пептида, помогающего найти на мембране рецептор. Липиды мембраны отличаются также значительной скоростью обмена, что требует для синтеза этих компонентов мембраны большого количества жирных кислот.
На специфику липидного состава мембран клеток влияют изменения среды обитания человека, характера его питания. Например, увеличение в пище жирных кислот с ненасыщенными связями увеличивает жидкое состояние липидов мембран клеток различных тканей, приводит к благоприятному для функции мембраны клетки изменению отношения фосфолипидов к сфингомиелинам и липидов к белкам. Избыток холестерина в мембранах, напротив, увеличивает микровязкость их бислоя фосфолипидных молекул, понижая скорость диффузии некоторых веществ через мембраны клеток. Пища, обогащенная витаминами А, Е, С, Р улучшает обмен липидов в мембранах эритроцитов, снижает микровязкость мембран. Это повышает деформируемость эритроцитов, облегчает выполнение ими транспортной функции (глава 6). Дефицит жирных кислот и холес-
18
терина в пище нарушает липидный состав и функции мембран клеток. Например, дефицит жиров нарушает функции мембраны нейтрофилов, что угнетает их способность к движению и фагоцитозу (активный захват и поглощение микроскопических инородных живых объектов и твердых частиц одноклеточными организмами или некоторыми клетками).
В регулировании липидного состава мембран и их проницаемости, регуляции пролиферации клеток важную роль играют активные формы кислорода, образующиеся в клетке сопряженно с нормально протекающими метаболическими реакциями (микросомальным окислением и др.). Образующиеся активные формы кислорода — супероксидный радикал (О2), перекись водорода (Н2О2) и др. представляют собой чрезвычайно реакционноспособные вещества. Их основным субстратом в реакциях свободнорадикального окисления являются ненасыщенные жирные кислоты, входящие в состав фосфоли-пидов мембран клетки (так называемые реакции перекисного окисления липидов). Интенсификация этих реакций может вызвать повреждение мембраны клетки, ее барьерной, рецепторной и обменной функций, модификацию молекул нуклеиновых кислот и белков, что ведет к мутациям и инактивации ферментов.
В физиологических условиях интенсификация перекисного окисления липидов регулируется антиоксидазной системой клеток, представленной ферментами, инактивируюшими активные формы кислорода — супероксиддисмутазой, каталазой, пероксидазой и веществами, обладающими антиокислительной активностью — токоферолом (витамин Е), убихиноном и др. Выраженный защитный эффект на мембраны клетки (цитопротекторный эффект) при различных повреждающих воздействиях на организм оказывают простагландины Е и J2, "гася" активацию свободнорадикального окисления. Простагландины защищают слизистую желудка и гепатоциты от химических повреждений, нейроны, клетки нейроглии, кардиомиоциты — от ги-поксических повреждений, скелетные мышцы -- при тяжелой физической нагрузке. Простагландины, связываясь со специфическими рецепторами на клеточных мембранах стабилизируют бислой последних, уменьшают потерю мембранами фосфолипидов.
Функции рецепторов мембран.Химический или механический сигнал вначале воспринимается рецепторами мембраны клетки. Следствием этого является химическая модификация мембранных белков, влекущая активацию "вторичных посредников", обеспечивающих быстрое распространение сигнала в клетке к ее геному, энзимам, сократительным элементам и т.д. Схематично трансмембранная передача сигнала в клетке может быть представлена следующим образом. Возбужденный воспринятым сигналом рецептор активирует у- белки мембраны клетки. Это происходит при связывании ими гуанозинтрифосфата (ГТФ). Взаимодействие комплекса "ГТФ-у- белки", в свою очередь, активирует фермент — предшественник вторичных посредников, расположенный на внутренней стороне мембраны. Предшественником одного вторичного посредника — цАМФ,
образующегося из АТФ, является фермент аденилатциклаза; предшественником других вторичных посредников — инозитол-трифос-фата идиацилглицерина, образующихся из фосфатидилинозитол-4,5-дифосфата мембраны, является фермент фосфолипаза С. Кроме того, инозитолтрифосфат мобилизует в клетке еще один вторичный посредник — ионы кальция, участвующие практически во всех регу-ляторных процессах в клетке. Так, например, образовавшийся инозитолтрифосфат вызывает выброс кальция из эндоплазматического ретикулума и повышение его концентрации в цитоплазме, тем самым включая различные формы клеточного ответа. С помощью ино-зитолтрифосфата и диацилглицерина регулируется функция гладких мышц и В-клеток поджелудочной железы ацетилхолином, передней доли гипофиза тиреогропин-релизинг фактором, ответ лимфоцитов на антиген и т.д. В некоторых клетках роль вторичного посредника выполняет цГМФ, образующийся из ГТФ с помощью фермента гу-анилатциклазы. Он служит, например, вторичным посредником для натрийуретического гормона в гладких мышцах стенок кровеносных сосудов. цАМФ служит вторичным посредником для многих гормонов — адреналина, эритропоэтина и др. (глава 3).
1.2. Цитоплазма. Клеточные органеллы (органоиды) и их основные функции.
Цитоплазма содержит различные структуры, расположенные в ци-тозоле. Цитозоль состоит из воды и находящихся в ней молекул — белков, глюкозы, электролитов, небольших количеств фосфолипидов, холестерина и т.д. Она служит средой для обмена веществ между различными органеллами. К последним относят эндоплазматический ретикулум, аппарат Гольджи, лизосомы, пероксисомы, микрофила-мент имикротрубочки, митохондрии, рибосомы. Часть цитоплазмы, прилегающая к мембране клетки и содержащая большое количество микрофиламента, называется эктоплазмой. Цитоплазма между нею и ядерной мембраной называется эндоплазмой.
Эндоплазматический ретикулум(ЭР) — система связанных между собой канальцев и полостей, образованных уплощенными мешочками. Их стенки состоят из бислойных липидных мембран, содержащих белки, фосфолипиды и большое количество ферментов. Размеры и форма ЭР зависят от функциональной активности его клетки. Внутреннее пространство ЭР отделено от цитоплазмы двойной ядерной мембраной и заполнено эндоплазматическим матриксом, отличным по составу от окружающей цитоплазмы. ЭР имеет также непосредственные контакты с митохондриальной и плазматической мембраной. Мембраны ЭР располагают ферментами, способными "накачивать" катионы кальция в ретикулум. Удержание катионов кальция в ретикулуме играет функциональную роль, например, в сократительных клетках (скелетных, гладких и сердечной мышцах), в которых механическая активность связана с увеличением свободного кальция в цитоплазме.
20
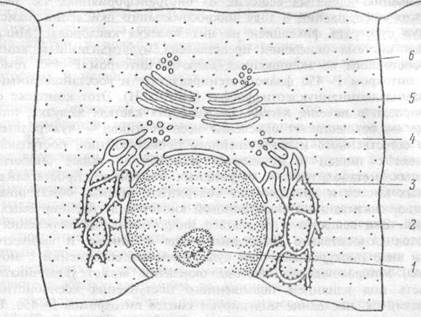
Рис. 1.3 Взаимоотношения эндоплазматического ретикулума, аппарата Гольджи и ядерной оболочки.
Эндоплазматический ретикулум гранулярный (2), гладкий (3); транспортные везикулы эндоплазматического ретикулума (4), аппарата Гольджи (5), секреторные везикулы (6), ядрышко в ядре клетки (1).
Эндоплазматический ретикулум различают (рис. 1.3): шероховатый (гранулярный) ЭР, связанный с прилегающими к нему рибосомами, и гладкий (агранулярный) ЭР, лишенный рибосом. Внутренняя часть гранулярного ЭР аккумулирует синтезированные рибосомами белки, которые транспортируются эндоплазматической сетью в составе транспортных пузырьков в аппарат Гольджи, а также к плазматической мембране клетки. Поэтому клетки, обильно синтезирующие белки — либо для секреции (гормоны в эндокринных клетках, антитела в плазмоцитах), либо для депонирования в специальных гранулах (ферменты в гранулах лейкоцитов) — богаты гранулярным ЭР. Напротив, клетки, синтезирующие белки для постоянной функции в цитоплазме (например, гемоглобин в эритробластах) содержат свободные полирибосомы, не связанные с ЭР. Белковые молекулы поступают через стенку ЭР в заполняющее его полужидкое, вязкое вещество — эндоплазматический матрикс и почти все они немедленно гликозилиру-ются под влиянием ферментов его мембраны (оставшиеся белки присоединяют углеводную группу в аппарате Голъджи). Поэтому белки ЭР представлены, в основном, гликопротеинами.
В агранулярном ЭР синтезируются липидные вещества (фосфолипи-ды, стероиды), содержатся ферменты, необходимые для синтеза гликогена в цитоплазме, протекают энзимные процессы, обеспечивающие
7/
детоксикацию ядовитых веществ, их биотрансформацию, т.е. ряд химических превращений в ходе микросомального окисления (окисления молекул субстрата фиксацией на них молекул кислорода). Микросо-мальная система окисления представлена мультиэнзимным комплексом, состоящим из монооксидаз, включая цитохром Р-450, гемопро-теин, цитохром Р-450 флавопротеинредуктазу и восстановленный ни-котинамидадениндинуклеотидфосфат (НАДФ-Н). Этот комплекс сконцентрирован в печени, легких, обкладочных клетках желудка, пладен-те, где он осуществляет окисление ксенобиотиков — чужеродных веществ естественного и искусственного происхождения, поступающих в организм с пищей и вдыхаемым воздухом, а также биологически активных метаболитов — стероидных гормонов, простагландинов, желчных кислот и др. Здесь же содержатся энзимы, обеспечивающие гидролиз, связывание с глюкуроновой кислотой детоксицируемых субстанций. Эти вещества в результате микросомального окисления оказываются относительно безвредными для организма и выводятся из него в виде глюкуроновых или сульфуроновых соединений с мочой и желчью. Микросомальная система окисления может увеличивать активность под влиянием повышенного поступления ксенобиотиков в организм, т.к. последние индуцируют синтез цитохромов Р-450. Вместе с тем, некоторые ксенобиотики в ходе микросомального окисления не понижают, а повышают токсичность. Такими свойствами обладают канцерогенные (вызывающие образование злокачественных опухолей) вещества — например, содержащиеся в табачном дыме и воздухе современных городов бензпирен, бензатрацен.
В ЭР и аппарате Гольджи протекает синтез липидов и белков, используемых для обновления мембран всех органелл клетки и плазматической мембраны. Синтезированные вещества транспортируются в виде пузырьков к этим мембранам. В ЭР синтезируются ферменты лизосом, поступающие в транспортных пузырьках к поверхности аппарата Гольджи.
Аппарат Гольджи(внутриклеточный сетчатый аппарат, зона, комплекс Гольджи) образован системой канальцев и цистерн, представляющих собой стопку плоских мешочков, от_поверхности которых отпочковываются секреторные пузырьки. Его функции тесно связаны с ЭР: от последнего отделяются транспортные пузырьки и сливаются с аппаратом Гольджи. Поступившие таким образом в аппарат Гольджи из ЭР белки и биологически активные вещества хранятся в уплотненном ("упакованном") виде в секреторных пузырьках или в формируемых здесь лизосомах.
В аппарате Гольджи синтезируются гликопротеиды. сиаловые кислоты, галактоза, а также глюкозаминогликаны (гиалуроновая кислота, хондроитин-сульфат и др.). Последние являются компонентами, поддерживающими деление и созревание кроветворных клеток в костном мозге, входят в состав органического матрикса в хрящах, костях, роговице и т.д., влияя на физические свойства тканей (упругость хрящей, прозрачность роговицы и т.п.). Гликопротеиды входят в состав слизи, секретируемой бокаловидными клетками кишеч-
22
ника и защищающей его эпителий. Секреторные пузырьки постоянно отделяются от аппарата Гольджи, диффундируя к мембране клетки и сливаясь с ней, а содержащиеся в везикуле вещества выводятся из клетки в ходе экзоцитоза. Благодаря участию аппарата Гольджи в секреторной функции клеток, он особенно хорошо развит в секреторных и нервных клетках.
Лизосомы— органеллы диаметром от 250 до 800 нм, окруженные бислойной мембраной, отпочковываются от стопок мешочков аппарата Гольджи. Лизосомы, отделяющиеся от мешочка аппарата Гольджи, называют первичными лизосомами. Они активно участвуют в фагоцитозе и эндоцитозе и содержат в высоких концентрациях более 50 различных кислых гидролаз, обеспечивающих расщепление биологических макромолекул — белков, нуклеиновых кислот, углеводов, жиров, фагоцитированных бактерий и клеток. Лизосомы содержат также энзимы, способные расщеплять капельки жиров и гранулы гликогена, гликолипиды фагоцитированных мембран старых и поврежденных клеток. При недостатке в организме аминокислот лизосомы расщепляют поступающие в клетку альбумины до аминокислот.
Таким образом, важнейшая функция лизосом — переваривание поступившего в клетку материала. После пиноцитоза (втягивание в клетку капельки жидкости из окружающей среды) или фагоцитоза, к пузырьку с захваченным материалом начинают присоединяться одна или несколько лизосом и опорожняют в него их содержимое, формируя вторичную лизосому. В результате фагоцитированный материал расщепляется до аминокислот, глюкозы и др., диффундирующих через мембрану вторичной лизосомы в цитоплазму и используемых для питания и обновления клетки. Остатки вторичных лизосом (остаточные тельца) экскретируются через клеточную мембрану в ходе экзоцитоза (распространенный механизм внешней и внутренней секреции).
Лизосомы ответственны за регрессию физиологически увеличенной массы ткани (матки, после перенесенной беременности и родов, молочных желез в конце периода лактации). Они содержат бактерицидные факторы — лизоцим, растворяющий мембрану фагоцитированных бактериальных клеток, лактоферрин, связывающий железо, необходимое для поддержания роста бактерий. Кислый рН лизосом (около 5,0) тормозит обмен в бактериях, ускоряя их гибель. Мембрана лизосом защищает содержимое клетки от действия ее гидролитических энзимов. Но многие факторы могут оказывать повреждающее действие на мембраны лизосом — физические — замораживание и размораживание тканей, их ультразвуковое облучение, химические — детергенты, образуемые в ходе метаболизма свободные радикалы (супероксидный радикал (О,), перекись водорода (Н2О2). С другой стороны, ряд веществ стабилизирует лизосомы, выполняет роль протектора их мембран (кортизон и др.).
Пероксисомы— внешне напоминают лизосомы, но сформированы, в основном, из гладкого ЭР и содержат, главным образом,
23
ферменты, катализирующие образование и разложение перекиси водорода. Образование перекиси водорода происходит под действием оксидаз, а разложение — под влиянием пероксидаз или каталаз, представленных в больших количествах в пероксисомах, например, в клетках печени. Перекись водорода — один из важнейших естественных окислителей и организме.
Митохондрии— "энергетические станции" клетки, в которых освобождается основное количество энергии из поступивших в организм питательных веществ. Митохондрии выглядят при электронной микроскопии как округлые, овальные или удлиненные органеллы от 3 до 40 нм в длину, от 2 до 10 нм в ширину, диаметр — от 0,2 до 1 мкм. Они состоят из 2 бислойных липидно-белковых мембран: наружной и внутренней (рис. 1.4). Внутренняя мембрана образует
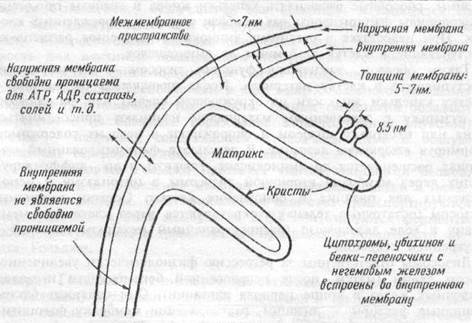
Рис. 1.4 Схема строения митохондрии.
удлинения, выступы входящие во внутреннее пространство митоход-рий — кристы. Она содержит энзимы электронтранспортной цепи, состоящей из 20 переносчиков электронов. Внутренняя полость митохондрий содержит растворенные в матриксе энзимы цикла Кребса, необходимые для освобождения энергии из питательных веществ. Здесь содержатся также ферменты, участвующие в синтезе жирных кислот. В ходе реакций энзимов цикла Кребса и системы транспорта электронов внутренней мембраны митохондрий питательные вещества окисляются до СО2 и воды, а освобождающаяся энергия используется для синтеза высокоэнергетической субстанции —
24
аденазинтрифосфата (АТФ). Затем молекулы АТФ из митохондрий диффундируют в клетку, обеспечивая энергией все клеточные функции (химическую, электрическую, осмотическую, механическую работу). Число митохондрий в клетке варьирует от 20 до 5 • 105, при этом они способны к самообновлению и пролиферации. Количество и размеры отдельных митохондрий увеличиваются при возрастании потребности ткани в энергии. Митохондрии содержат дезоксирибо-нуклеиновую кислоту (ДНК), различные классы рибонуклеиновых кислот (РНК),обеспечивающих обновление и синтез новых митохондрий.
Микрофиламенты— нитевидные структуры (микрофибриллы) и микротрубочки. Микрофибриллы — актин и миозин — компоненты сократительного аппарата клетки. Микротрубочки составляют основу цитоскелета, прилегающего к мембране с цитоплазматической стороны клетки. Они организованы из лежащих параллельно микроволокон, образующих длинные пустые цилиндры до 25 им Я диаметре и более 2 мкм в длину. Микротрубочки часто уложены в связки, что обеспечивает значительную прочность и жесткость цитоскелету. Микротрубочки образуются при полимеризации белка тубулина. Микрофибриллы и микротрубочки участвуют ворганизации митоти-ческих веретен, в процессах морфогенеза, обеспечивают движения мембраны клетки во время эндоцитоза и экзоцитоза, создают эластическую поддержку для клеточной мембраны. Благодаря микрофи-ламенту клетки могут изменять форму (тромбоциты при стимуляции образуют цитоплазматические выросты, усиливающие склеивание тромбоцитов друг с другом), перемешаться в тканях, образуя двигательные выступы цитоплазмы — псевдоподии (нейтрофильные лейкоциты, макрофаги и др.). Другие специальные органоиды движения — реснички и жгутики представляют собой плазматические выросты на свободной поверхности клеток. Сокращаясь, реснички перемещают жидкость, пылевые частицы (мерцательный эпителий трахеи, бронхов), а жгутики — клетки (сперматозоиды).
Рибосомы— электронноплотные частицы диаметром от 10 до 25 нм, содержащие, главным образом, рибосомальную РНК и белки. Они включают две субъединицы разной молекулярной массы. Взаимодействие с информационной РНК (иРНК) и транспортной РНК (тРНК) позволяет им обеспечить синтез белков. В цитоплазме рибосомы могут лежать отдельно одна от другой, но чаще они сгруппированы в ансамбль из 6-10 единиц, формируя полирибосомы (полисомы), необходимые для синтеза цепей белковых комплексов (например, легкие или тяжелые цепи иммуноглобулина, цепи а- и В-гемоглобина и т.д.). В цитоплазме рибосомы либо связаны между собой тонкой цепью иРНК, либо свободно лежат в ней в форме изолированных гранул, но в большинстве случаев они связаны с наружной частью мембраны эндоплазматического ретикулума. Синтезированные на них белки затем транспортируются через мембрану в просвет канальцев ицистерн ретикулума.
25
1.3. Клеточное ядро. Митоз.
Ядро— центральный элемент клетки. Его оперативное удаление дискоординирует функции цитоплазмы. Ядро играет главную роль в передаче наследственных признаков и синтезе белков. Передача генетической информации от одной клетки к другой обеспечивается дез-оксирибонуклеиновой кислотой (ДНК), содержащейся в хромосомах. Удвоение ДНК предшествует клеточному делению. Масса ядра в клетках разных тканей различна и составляет, например, 10-18% от массы гепатоцита, 60% — в лимфоидных клетках. В интерфазе (межмитоти-ческом периоде) ядро представлено четырьмя элементами: хроматином, нуклеолой (ядрышком), нуклеоплазмой и ядерной мембраной.
Хроматин— это окрашенные основными красителями многочисленные гранулы, из которых сформированы хромосомы. Хромосомы же образованы комплексом нуклеопротеинов, содержащих нуклеиновые кислоты и белки. Различают два вида хроматина в находящихся в интерфазе ядрах клеток человека — дисперсный, слабо окрашенный хроматин (эухроматин), сформированный длинными, тонкими, переплетенными волокнами, метаболически очень активный и конденсированный хроматин (гетерохроматин), соответствующий районам хромосом, не вовлеченным в процессы контроля метаболической активности. Для зрелых клеток (например, крови) характерны ядра богатые плотным, конденсированным хроматином, лежащим глыбка-ми. В ядрах соматических клеток женщин он представлен глыбкой хроматина, сближенного с мембраной ядра: это женский половой хроматин (или тельца Барра), представляющий собой конденсированную Х-хромосому. Мужской половой хроматин представлен в ядрах мужских соматических клеток глыбкой, светящейся при окраске флюорохромами. Определение полового хроматина используется, например, для установления пола ребенка по клеткам, полученным из околоплодной жидкости беременной женщины.
Ядрышко— внутриядерная структура сферической формы, не имеющая мембраны. Оно развито во всех клетках, отличающихся высокой активностью белкового синтеза, что связано с образованием в нем субъединиц цитоплазмы, рРНК. Например, ядрышки обнаруживаются в ядрах способных к делению клеток — лимфобластах, миелобластах и др.
Мембрана ядрапредставлена двумя листами, просвет между которыми соединен с полостью эндоплазматического ретикулума. Мембрана имеет отверстия (ядерные поры) приблизительно до 100 нм в диаметре, через которые свободно проходят макромолекулы (рибо-нуклеазы, РНК). Вместе с тем, ядерная мембрана и поры поддерживают микросреду ядра, обеспечивая избирательный обмен различных веществ между ядром и цитоплазмой. В малодифференцирован-ной клетке поры занимают до 10% поверхности ядра, но с созреванием клетки их суммарная поверхность уменьшается.
26
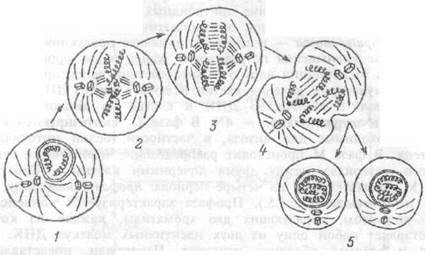
Рис.1.5 Различные фазы митоза соматической клетки.
/ — профаза, 2 — метафаза, 3 — анафаза, 4 — телофаза, 5 — формирование двух дочерних клеток.
Нуклеоплазма(ядерный сок) представляет собой коллоидный раствор, содержащий белки, который обеспечивает обмен метаболитов ибыстрое перемещение молекул РНК к ядерным порам. Количество нуклеоплазмы уменьшается при созревании или старении клетки.
Деление клеток.Митоз (рис. 1.5)занимает лишь часть клеточного цикла. В клетках млекопитающих фаза митоза (М) длится около часа. За нею следует постмитотическая пауза (G1), для которой характерна высокая активность биосинтеза белков в клетке, реализуются процессы транскрипции и трансляции. Продолжительность паузы около 10 часов, но это время значительно варьирует и зависит от влияния регулирующих факторов, стимулирующих и тормозящих деление клеток, от снабжения их питательными веществами. Следующая фаза клеточного цикла характеризуется синтезом (репликацией) ДНК(фаза S) и занимает около 9 часов. Далее следует премитотическая фаза G2, продолжающаяся около 4 часов. Таким образом, весь клеточный цикл длится около 24 часов:
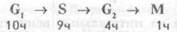
Клетки могут находиться также в фазе покоя — Go, длительно оставаясь вне клеточного цикла. Например, у человека до 90% стволовых кроветворных клеток находится в фазе Go, но их переход из Go в G1 ускоряется при возрастании потребностей в клетках крови.
Высокая чувствительность клеток к регулирующим их деление факторам в фазе G1 объясняется синтезом на мембранах клеток в
27
этот период рецепторов гормонов, стимулирующих и ингибирующих факторов. Например, деление эритроидных клеток костного мозга в фазе G, стимулирует гормон эритропоэтин. Тормозит этот процесс ингибитор эритропоэза — вещество снижающее продукцию эритроцитов в случае уменьшения потребностей тканей в кислороде (глава 6).
Передача информации ядру о взаимодействии рецепторов мембраны со стимулятором деления клетки включает синтез ДНК, т.е. фазу S. В результате количество ДНК в клетке из диплоидного, 2N, переходит в тетраплоидное — 4N. В фазе G2 синтезируются структуры, необходимые для митоза, в частности, белки митотического веретена. В фазе М происходит распределение идентичного генетического материала между двумя дочерними клетками. Собственно фаза М подразделяется на четыре периода: профазу, метафазу, анафазу и телофазу (рис.1.5.). Профаза характеризуется конденсацией ДНКхромосом, образующих две хроматиды, каждая из которых представляет собой одну из двух идентичных молекул ДНК.Нук-леола и ядерная оболочка исчезают. Центриоли, представленные тонкими микротрубочками расходятся к двум полюсам клетки, образуя митотическое веретено.
В метафазу хромосомы располагаются в центре клетки, образуя метафазную пластинку, В эту фазу морфология каждой хромосомы наиболее отчетлива, что используется на практике для исследования хромосомного набора клетки. Анафаза характеризуется движением хроматид, "растаскиваемых" волокнами митотического веретена к противоположным полюсам клетки. Телофаза характеризуется образованием ядерной мембраны вокруг дочернего набора хромосом. Знание особенностей клеточного цикла используется на практике, например, при создании цитостатических веществ для лечения лейкозов. Так, свойство винкристина быть ядом для митотического веретена используется для остановки митоза лейкозных клеток.
Дифференциация клеток— есть приобретение клеткой специализированных функций, связанное с появлением в ней структур, обеспечивающих выполнение этих функций (например, синтез и накопление гемоглобина в эритроцитах характеризует их дифференциацию в эритроциты). Дифференциация связана с генетически запрограммированным торможением (репрессией) функций одних участков генома и активацией других.
1.4. Образование энергии в клетке.
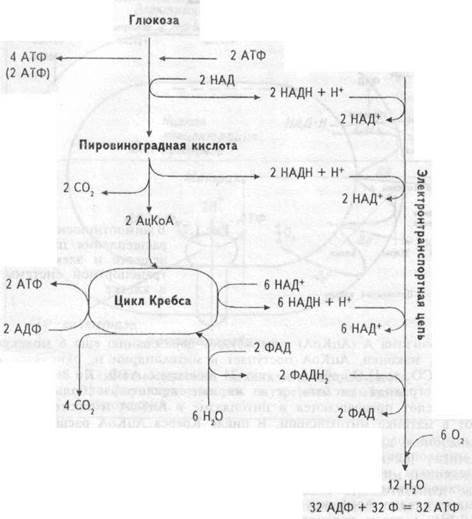
Извлечение энергии из питательных веществ — углеводов, белков, жиров происходит, в основном, внутри клетки. В ней все углеводы представлены глюкозой, белки — аминокислотами, жиры — жирными кислотами. В клетке глюкоза под влиянием энзимов цитоплазмы превращается в пировиноградную кислоту (в ходе анаэробного гликолиза) (рис. 1.6). В ходе этих превращений из одной молекулы глюкозы образуется 2 молекулы АТФ (не считая 2 молекул АТФ, фосфорилирующих субстрат). Превращение пирувата в 2 молекулы
28
| Источник энергии | Реакция | Выход молекул АТФ |
| Фосфолирирование субстрата | Гликолиз | |
| 2 Н2 (4 Н) | Гликолиз | |
| 2Н2(4 Н) | Пируват — АцКоА | |
| Фосфорилирование субстрата | Цикл Кребса | |
| 8Н2(16Н) | Цикл Кребса |
36 АТФ
Рис. 1.6 Образование АТФ при полном окислении глюкозы
29

|
| Рис.1.7 Взаимоотношения расщепления пищевых веществ и электрон-транспортной системы в клетке |
ацетилкоэнзима А (АцКоА) способствует образованию еще 6 молекул АТФ. И, наконец, АцКоА поступает в митохондрии и, окисляясь в них до СО2 и Н2О, образует еще 24 молекулы АТФ. Но не только пировиноградная кислота, а и жирные кислоты и большинство аминокислот превращаются в цитоплазме в АцКоА и также поступают в матрикемитохондрий. В цикле Кребса АцКоА расщепляется до атомов водорода и окиси углерода. Окись углерода диффундирует из митохондрий, и далее из клетки. Атомы водорода соединяются с окисленным никотинамидадениндинуклеотидом (НАД+), формируя восстановленный НАД (НАДН), и с окисленным никотинамидаде-ниндинуклеотид фосфатом (НАДФ), формируя восстановленный НАДФН, а затем переносятся молекулами — переносчиками водорода от НАДН и НАДФН на систему ферментов внутренней мито-хондриальной мембраны. В результате НАДН и НАДФН отдают один протон и два электрона в электротранспортную цепь, образуемую этими ферментами (рис.1.7). В ходе передачи электронов в цепи переносчиков возрастают окислительно- восстановительные потенциалы — от отрицательных значений до потенциала восстановления О2. Эта разница окислительно-восстановительных потенциалов и образует ту движущую силу, которая приводит к синтезу АТФ. Описанный перенос электронов и протонов от НАДН и НАДФН по цепи транспорта электронов называется окислительным фосфорилировани-ем. Согласно хемиосмотической теории, объясняющей механизм образования энергии при окислительном фосфорилировании, в ходе передачи электронов по электронно-транспортной цепи, пара электронов три раза пересекает внутреннюю мембрану митохондрий, каждый раз перенося два протона наружу (рис. 1.8). В результате

Рис. 1.8 Хемиосмотический механизм окислительного фосфорилирования во внутренней мембране митоходрий.
возникает высокая концентрация протонов снаружи мембраны, и низкая — в матриксе митохондрий и, как следствие, разница в электрическом потенциале между наружным (имеющим положительный заряд) и внутренним (накапливающим отрицательный заряд) слоем мембраны. Оба эти фактора (электрическое поле и разность концентраций) формируют электрохимический трансмембранный протонный градиент, благодаря которому протоны начинают возвращаться назад через мембрану. Это обратное движение протонов осуществляется через мембранный белок, к которому присоединяется АТФ-синтетаза, расположенная на внутренней (матричной) стороне мембраны. Взаимодействие мембранного белка с АТФ-синте-тазой активирует ее и сопровождается синтезом АТФ из аденозин-дифосфорной (АДФ) и фосфорной кислот (Фн). Следовательно, поток протонов через мембрану активирует реакцию:
АДФ + Фн -» АТФ + Н2О
Энергия протонного градиента также обеспечивает транспорт ионов кальция и натрия через мембрану митохондрий, восстановление в них НАДФ+ с помощью НАДН, образование тепла. Молекулы АТФ, образовавшиеся в ходе гликолиза и окислительного фосфорилирования
31
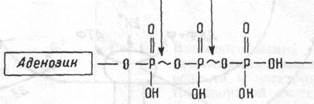
используются клеткой для обеспечения энергией почти всех внутриклеточных метаболических реакций. Макроэргические фосфатные связи молекулы АТФ очень нестойки и концевые фосфатные группы легко отщепляются от АТФ, освобождая энергию (7-10 ккал/моль АТФ) (рис. 1.9). Энергия передается переносом отщепившихся, богатых энергией фосфатных групп на различные субстраты, ферменты, активируя их, расходуется на мышечное сокращение и т.п.


 Рис. 1.9 Схема молекулы АТФ.
Рис. 1.9 Схема молекулы АТФ.
Тpuфocфam Высокоэнергетические связи.
 Энергетическая фосфогенная система.Энергия макроэргических связей молекулы АТФ является универсальной формой запаса свободной энергии в организме. Вместе с тем, количество АТФ, хранимое внутри клетки невелико. Оно обеспечивает ее работу лишь в течение нескольких секунд. Это обстоятельство привело к формированию чувствительных механизмов, регулирующих энергетический обмен в скелетной, сердечной и нервных клетках. В этих тканях присутствуют органические фосфатные соединения, накапливающие энергию в форме фосфатных связей и представляющие собой источник этих богатых энергией фосфатных групп для синтеза АТФ. Органические фосфатные соединения получили название фосфагенов. Наиболее важным из них у человека является креатинфосфат (КФ). При его расщеплении высвобождается энергия до 10 ккал/моль, используемая для ресинтеза АТФ. Снижение содержания АТФ в этих тканях ведет к распаду КФ, а увеличение концентрации АТФ — к его ресинтезу. Так, в скелетной мышце концентрация КФ в 3-5 раз больше, чем АТФ. Гидролиз КФ (на креатин и фосфат) под влиянием фермента креатинкиназы обеспечивает ресинтез АТФ, являющейся источником энергии для мышечного сокращения:
Энергетическая фосфогенная система.Энергия макроэргических связей молекулы АТФ является универсальной формой запаса свободной энергии в организме. Вместе с тем, количество АТФ, хранимое внутри клетки невелико. Оно обеспечивает ее работу лишь в течение нескольких секунд. Это обстоятельство привело к формированию чувствительных механизмов, регулирующих энергетический обмен в скелетной, сердечной и нервных клетках. В этих тканях присутствуют органические фосфатные соединения, накапливающие энергию в форме фосфатных связей и представляющие собой источник этих богатых энергией фосфатных групп для синтеза АТФ. Органические фосфатные соединения получили название фосфагенов. Наиболее важным из них у человека является креатинфосфат (КФ). При его расщеплении высвобождается энергия до 10 ккал/моль, используемая для ресинтеза АТФ. Снижение содержания АТФ в этих тканях ведет к распаду КФ, а увеличение концентрации АТФ — к его ресинтезу. Так, в скелетной мышце концентрация КФ в 3-5 раз больше, чем АТФ. Гидролиз КФ (на креатин и фосфат) под влиянием фермента креатинкиназы обеспечивает ресинтез АТФ, являющейся источником энергии для мышечного сокращения:
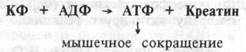
Освободившийся креатин вновь используется клеткой для аккумуляции энергии в креатинфосфате. Этот эффект сохраняет концентрацию АТФ в клетке на относительно постоянном уровне. Поэтому фосфокреатин клеток скелетной мышцы и ее АТФ составляют, так называемую, энергетическую фосфогенную систему. Энергия фосфо-
32
генной системы используется для обеспечения "рывковой" мышечной активности, продолжительностью до 10-15 секунд, т.е. максимальной мышечной мощности, достаточной для бега на 100-метровую дистанцию.
Дата добавления: 2015-09-11; просмотров: 2105;
