Химические свойства. Химические свойства алкенов определяются наличием в их молекулах двойной связи
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Входящая в ее состав π-связь легко разрушается, и по месту разрыва могут присоединяться различные реагенты. Таким образом, для алкенов наиболее характерны реакции присоединения:
| |
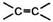 +XY ® – С – C –
+XY ® – С – C –
| |
X Y
| Тип, название реакции | Примеры реакций |
| I. Реакции присоединения 1. Гидрирование (образуются алканы) | T,Ni СН2=СН—СН3 + Н2 ® СН3—СН2—СН3 пропен пропан |
| 2. Галогенирование (образуются дигалогеналканы) | СН2=СН2 + Cl2 ® Cl–CH2–CH2–Cl этен 1,2-дихлорэтан СН3–СН=СН–СН3+ Вг2 ® СН3–СН–СН–СН3 бутен-2 (H2O) | | Br Br 2,3-дибромбутан |
| Реакция с бромной водой (р-р Вг2 в Н2О) является качественной реакцией на алкены и другие непредельные УВ (бромная вода обесцвечивается) | |
| 3. Гидрогалогенирование (образуются галогеналканы) | СН2=СН2 + HCl ® СН3–CH2–Cl этен хлорэтан Br | СН2=СН–СН3 + НВг ® СН3–СН–СН3 пропен 2-бромпропан Последняя реакция протекает в соответствии с правилом Марковникова: при присоединении молекул типа НХ к несимметричным алкенам атом водорода присоединяется к более гидрогенизированному атому углерода двойной связью |
| 4. Гидратация (образуются предельные одноатомные спирты алканолы) | T,H+ СН2=СН2 + НОН ® CH3–CH2–OH этен этанол T,H+ СН2=СН–СН2–СН3 + НОН ® CH3–CH–CH–CH3 бутен-1 | OH бутанол-2 |
| II. Реакции окисления 1. Горение | T С2Н4 + 3О2 ® 2СО2 + 2Н2О |
| 2. Неполное каталитическое окисление | Ag,2000C
2СН2=СН2 + O2 ® 2 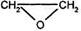 этиленоксид
этиленоксид
|
| 3. Окисление перманганатом калия в нейтральной или щелочной среде (образуются двухатомные спирты-гликоли) — реакция Вагнера | 3CH2=CH2+2KMnO4+ 4H2O®3CH2–CH2+2KOH+2MnO2¯ этилен | | OH OH этиленгликоль или упрощенно: CH2–CH2 + (O) + H2O ® CH2–CH2 | | OH OH Используется как качественная реакция на алкены и другие непредельные УВ (р-р КМnО4 обесцвечивается) |
| 4. Окисление перманганатом калия в кислой среде (образуются карбоновые кислоты) — окислительное расщепление двойной связи | H+
CH3–CH=CH–CH3 + 4(O) ® 2 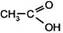 бутен-2 (из KMnO4) уксусная кислота
H+
CH2=CH–CH3 + 4(O) ®
бутен-2 (из KMnO4) уксусная кислота
H+
CH2=CH–CH3 + 4(O) ® 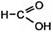 + + 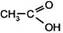 пропен (из KMnO4) муравьиная уксусная ки слоты
пропен (из KMnO4) муравьиная уксусная ки слоты
|
| III. Реакции полимеризации | T,P,kat n CH2=CH2 ® (–CH2–CH2–)n этилен(мономер) полиэтилен(полимер) T,P,kat n CH2=CH–CH3 ® ( –CH2–CH– )n пропилен | CH3 полипропилен |
Способы получения
| Название способа | Уравнения реакций |
| 1. Дегидрирование алканов | T,P,kat CnH2n+2 ® CnH2n + Н2 |
| 2. Гидрирование алкинов | Ni CnH2n-2 + Н2 ® CnH2n |
| 3. Крекинг алканов | См. «Алканы» |
| 4. Дегидратация спиртов (алканолов) | H2SO4(конц.),~1700C CH3–CH2–OH ® CH2=CH2 + H2O этанол этен H2SO4(конц.),~1700C CH3–CH–CH2–CH3 ® CH3–CH=CH–CH3 + H2O | OH бутанол-2 бутен-2 Последняя реакция протекает в соответствии с правилом Зайцева: при отщеплении молекул типа НХ атом водорода отрывается от менее гидрогенизированного соседнего атома углерода |
| 5. Дегидрогало-генирование гало-геналканов под действием спиртового р-ра щелочи | Т CH3–CH2–Cl + KOH ® CH2=CH2 + KCl + H2O хлорэтан (спирт. р-р) этен Т CH3–CH2–CH–CH3+NaOH ® CH3–CH=CH–CH3+NaBr+H2O | (спирт. р-р) Br 2-бромбутан бутен-2 |
| 6. Дегалогенирование дигалогеналканов под действием магния или цинка | Т CH3–CH2–CH–CH2+Mg ®CH3–CH2–CH=CH2 + MgBr2 | | Br Br 1,2-дибромбутан бутен-1 (2 атома галогена должны находиться у соседних атомов углерода.) |
Дата добавления: 2015-11-20; просмотров: 1226;
