Условия титрование, среда.
МЕТОДЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ. ЙОДОМЕТРИЯ
ОСНОВЫ МЕТОДА
Иодометрия — титриметрический (объёмный) метод определения веществ, основанный на реакциях окисления-восстановления (разновидность оксидиметрии) с участием иода или иодида калия
Реакция метода.Йодометрия основана на реакции восстановления свободного йода до йодид-ионов или окисления йодид-ионов в свободный йод - (обратная реакция):
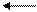
 I20 +2е +2 I-;
I20 +2е +2 I-;
Т.к. реакции протекают в присутствии избытка иодида калия,то правильнее записывать процесс 
Стандартный электродный потенциал данной реакции составляет +0,5355 В.
Йодометрическим титрованием определяют как окислители, так и восстановители.
Титранты. Применяют растворы натрий тиосульфата и йода 0,1н. и 0,01 н. концентрации. Растворы натрия тиосульфата применяют для титрования свободного йода.
I2 + 2S2 О32- ® 2I- + S4O62-.
При проведении этой реакции йод восстанавливается до йодид-ионов, тиосульфат-ионы окисляются до тетратионат-ионов S4O62-.
Э I2=М/2=126,9; ЭNа2s2o3=M/1=248,2.
Вопрос: зачем нужен второй титрант?
В основе метода ИОДОметрии лежит реакция взаимодействия иодид-ионов с окислителем Ох с образованием иода и восстановителя Red:
2I⁻ + Ox = I2 + Red
Иодид-ион — довольно эффективный восстановитель. Однако растворы иодида калия непосредственно не применяются в качестве титранта, так как они неустойчивы и окисляются кислородом воздуха.
На практике к анализируемому раствору определяемого окислителя прибавляют избыток иодида калия. Иод, выделяющийся в качестве замести-теля в количестве, эквивалентном количеству вступившего в реакцию окис-лителя Ох, оттитровывают стандартным раствором тиосульфата натрия:
I2 + 2Na2S2O3 = 2NaI + Na2S2O6
Количество израсходованного титранта — раствора тиосульфата натрия — эквивалентно количеству образовавшегося иода и, следовательно, количеству определяемого окислителя Ох, провзаимодействовавшего с иодид-ионами.
Условия титрование, среда.
Для проведения иодиметрического титрования необходимо соблюдать ряд условий, важнейшими из которых являются следующие.
1) Титрование раствором иода следует проводить на холоду во избежание улетучивания иода. Кроме того, обычно применяемый в иодиметрии в качестве индикатора крахмал становится менее чувствительным при повышении температуры.
2) ОВ потенциал редокс-пары I2/I⁻ невелик. Константы равновесия ОВ реакций с участием этой редокс-пары имеют невысокие значения, реакции не идут до конца. Для увеличения полноты протекания реакций титрование часто ведут в присутствии веществ, связывающих продукты реакции в прочные комплексы.
3) ОВ потенциал редокс-пары I2/I⁻ теоретически не зависит от рН раствора, так как в соответствующей полуреакции не участвуют ни ионы водорода, ни гидроксильные группы. Тем не менее, кислотность среды влияет на результаты иодиметрического титрования.
В щелочной или кислой среде могут возникнуть побочные реакции.
В щелочных растворах при рН> 9 протекает побочная реакция :I2 образует гипогалоиды:
I2 + 2OH⁻ = IO⁻ + I⁻ + Н2O
что повышает ошибку анализа. К тому же образующиеся анионы IO⁻ сами являются окислителями и могут взаимодействовать с определяемым веществом-восстановителем.( Эту реакцию также применяют для титриметрических определений-см.далее)
В сильнокислой среде иодид-ионы образуют иодоводородную кислоту HI, разлагающуюся с заметной скоростью на свету и под действием кислорода воздуха с выделением иода по схеме
4НI + O2 = 2Н2O + 2I2
Поэтому иодиметрическое титрование проводят в слабокислых, нейтральных растворах и слабощелочных (рН<8) растворах
Дата добавления: 2015-11-18; просмотров: 4031;
