ПРИМЕНЕНИЕ ИОДОМЕТРИИ В АНАЛИЗЕ ЛС.
Из неорганических соединений йодометрией анализируют йод, калий перманганат, натрий арсенат, каломель, медь сульфат. Метод применим и ко многим органическим лекарственным препаратам (формалин, анальгин и др.).
Прямое титрование раствором Na2S2O3 .Анализируют йод и настойку йода.
Анализ йода проводят следующим образом.
Во взвешенную колбу с 10 мл 20% раствора калий йодида добавляют около 0,2 г йода, растертого в ступке, и снова взвешивают колбу. (Такой способ взятия навески йода принят во избежание улетучивания йода. ) Раствор разводят до 20 мл и титруют 0,1 н. раствором натрий тиосульфата до желтого окрашивания. Добавляют 1 мл раствора крахмала, раствор синеет, титрование ведут до обесцвечивания раствора. TNa2S2O3/ I 2 = 0,01269 г/ мл.
Прямое титрование раствором иода
Прямое иодиметрическое титрование непосредственно раствором I2 может быть использовано, в частности, для титрования восстановителей в присутствии избытка KI..Этим способом определяют концентрацию As(III), Sn(II), Sb(III), сульфидов, сульфитов, тиосульфатов и др.,например
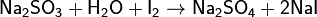
В ККЛС применяют при анализе тиосульфата натрия, анальгина, аскорбиновой кислоты.
Методика.Точную навеску тиосульфата натрия (= 0,8г) растворяют в 25 мл воды, добавляют 1 мл раствора крахмала и титрируют до появления синего окрашивания раствора.
2Na2S2O3+I2 ®Na2S4O6 + 2NaI;
Обратное титрование
Возможно также определение восстановителей избытком иода, непрореа-гировавшее количество которого определяется титрованием тиосульфатом натрия.
Этот вариант используют в анализе каломели, формальдегида, антипирина.
Каломель анализируют, добавляя точно известный объём раствора иода в заведомом избытке и йодид калия. При этом Hg22+ окисляется до Hg2+.
Избыток непрореагировавщего йода титруют 0,1 н раствором тиосульфата натрия.
Hg2CI2 +J2 + 6KJ → 2K2[HgJ4] + 2KJ+2KCI
Опред.в-во Титрант 1
J2 +2Na2S2O3 → 2NaJ + Na2S4O6
Титрант 2
T I 2/Hg2 CI2 = 0,02361 г/ мл.
Титрованием заместителя
Косвенное иодометрическое титрование используется для титрования окислителей; в этом случае определяемые вещества взаимодействуют с избытком KI с образованием иода, который оттитровывается раствором тиосульфата натрия.
В фарманализе определяют перманганат калия, арсенат натрия, сульфат меди(II), коразол , пероксиды водорода, магния.бария и.т.п.
Так, например, пероксид водорода определяют в кислой среде на основе реакций:
Н2O2 +2КI +Н2SО4 = I2 + К2SО4 + 2Н2O
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Для проведения анализа
в коническую колбу с аликвотой раствора пероксида водорода прибавляют серную кислоту, раствор иодида калия в избыточном количестве по сравнению со стехиометрическим, одну-две капли раствора молибдата аммония (катализатор), покрывают колбу стеклом (во избежание потерь паров иода) и оставляют в темном месте на 10 минут для того, чтобы реакция прошла с наибольшей полнотой.
Выделившийся иод титруют стандартным раствором тиосульфата натрия до соломенно-желтой окраски (цвет остаточного иода), после чего добавляют несколько капель раствора крахмала — титруемый раствор тотчас синеет. Продолжают титровать раствор до исчезновения синей окраски.
Концентрацию пероксида водорода рассчитывают с учетом того, что его фактор эквивалентности в данном случае равен 1/z = 1/2 в соответствии с полуреакцией
Н2O2 +2е +2Н+ = 2Н2O; z = n =2.
Следовательно,
N (H2О2) =N(Na2S2O3)V( Na2S2O3)V(H2O2),
В этом способе к раствору препарата добавляют иодид калия, в итоге окисления KJ образуется количественно заместительJ2, который определяется титрованием, раствором Na2S2O3.
Например,КМn04 анализируют, растворяя точную навеску в воде, в мерной колбе, к части раствора добавляют 20% растворKJ и после 10 минутного стояния выделившийся йод титруют 0,1н растворомNa2S2O3.
2KMnO4 + 10KJ +8H2SO4→2 MnSO4 + 6К2SO4 +5J2 + 8H2O
Дата добавления: 2015-11-18; просмотров: 4402;
