Правила коагуляции электролитами
Коагуляция наблюдается при добавлении некоторого количества любого электролита, химически не реагирующего с дисперсной фазой системы. Наблюдениями Г.Шульце было установлено, что коагуляцию вызывает один из ионов электролита. Этот ион называют ионом-коагулятором. Причём, коагулирующая способность иона возрастает с увеличением заряда иона в геометрической прогрессии при соотношении 1:100:1000 (правило значности или правило Шульце). Ландау, Дерягиным установлено, что коагулирующая способность изменяется в соответствии 6-ой степени заряда ионов: 16:26:36 = 1:64:729.
Позже М.Гарди выявил, что заряд коагулирующего иона всегда противоположен заряду гранулы мицеллы (правило Гарди). Следовательно, отрицательная гранула коагулирует под влиянием положительно заряженных ионов, а положительно заряженная гранула – под действием анионов добавляемого электролита.
Закономерности, найденные Шульце и Гарди объединены в одно правило (правило Шульце-Гарди): коагулирующим действием обладает тот ион электролита, заряд которого противоположен заряду гранулы и коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора.
Для характеристики и сравнения различных электролитов используется понятие «порог коагуляции» − это минимальная концентрация добавляемого электролита, при которой начинается (наблюдается) коагуляция:
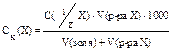 , моль/л.
, моль/л.
Порог коагуляции зависит от ряда условий: от момента фиксирования после добавления электролита; от метода наблюдения; от концентрации исследуемого раствора и добавляемого электролита. Порог коагуляции определяют путем измерения светорассеяния или титрованием коллоидного раствора электролитом до начала явной коагуляции.
Величина, обратная порогу коагуляции называют коагулирующей способностью: 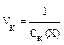 . Она выражает объем золя, скоагулированного под действием 1 ммоль иона-коагулятора. Чем выше коагулирующая способность, тем меньше электролита для вызова коагуляции.
. Она выражает объем золя, скоагулированного под действием 1 ммоль иона-коагулятора. Чем выше коагулирующая способность, тем меньше электролита для вызова коагуляции.
Коагулирующая способность зависит от атомной массы и заряда, т.е. плотности заряда иона. С увеличением атомной массы плотность заряда уменьшается, ионы становятся менее поляризованными. В результате утоньшается их сольватная оболочка. Поэтому большие ионы легче проникают в адсорбционный слой мицеллы и нейтрализуют заряд частицы, вызывая коагуляцию золя. Например, для золя иодида серебра состава {mAgI, nI−(n−x)K+}xK+ индифферентными электролитами являются KNO3, NaNO3, Ca(NO3)2, Al(NO3)3, Th(NO3)4 , а ионами-коагуляторами ионы K+, Na+, Ca2+, Al3+, Th4+ . Коагулирующая способность ионов возрастает в ряду: Li+ < Na+ < K+ < Rb+ < Cs+ или Na+ < Ca2+ < Al3+ < Th4+. Чем меньше гидратация (сольватация) катиона, тем меньше порог коагуляции, т.е. сильнее коагулирующее действие. Гидратная оболочка увеличивает размер иона и препятствует проникновению иона в адсорбционный слой. Коагулирующая способность органических соединений возрастает в соответствии правила Траубе.
Дата добавления: 2015-11-12; просмотров: 2418;
