Возрастные изменения крови
Число эритроцитов в момент рождения и в первые часы жизни выше, чем у взрослого человека, и достигает 6,0-7,0×1012/л. К 10-14-м сут оно равно тем же цифрам, что и во взрослом организме. В последующие сроки происходит снижение числа эритроцитов с минимальными показателями на 3-6-м мес жизни (физиологическая анемия). Число эритроцитов становится таким же, как и во взрослом организме, в период полового созревания. Для новорожденных характерны наличие анизоцитоза (разнообразие размеров эритроцитов) с преобладанием макроцитов, увеличенное содержание рети-кулоцитов, а также присутствие незначительного числа ядросодержащих предшественников эритроцитов.
Число лейкоцитов у новорожденных увеличено и достигает 10,0-30,0×109/л. В течение 2 нед после рождения число их снижается до 9,0-15,0×109/л. Количество лейкоцитов достигает к 14-15 годам уровня, свойственного взрослым. Соотношение числа нейтрофилов и лимфоцитов у новорожденных такое же, как и у взрослых. В последующем содержание лимфоцитов возрастает, а нейтрофилов - снижается; таким образом, к 4-м сут количество этих видов лейкоцитов уравнивается (первый физиологический перекрест лейкоцитов). Дальнейшее возрастание числа лимфоцитов и снижение числа нейтрофилов приводят к тому, что на 1-2-м году жизни лимфоциты составляют 65 %, а нейтрофилы - 25 %. Новое снижение числа лимфоцитов и повышение числа нейтрофилов приводят к выравниванию обоих показателей у 4-летних детей (второй физиологический перекрест). Постепенное снижение содержания лимфоцитов и повышение числа нейтрофилов продолжаются до полового созревания, когда количество этих видов лейкоцитов достигает нормы взрослого.
7.3. ЛИМФА
Лимфа (лат. lympha - влага) представляет собой слегка желтоватую жидкость белковой природы, протекающую в лимфатических капиллярах и сосудах. Она состоит из лимфоплазмы (plasma lymphae) и форменных элементов. По химическому составу лимфоплазма близка к плазме крови, но содержит меньше белков. Среди фракций белка альбумины преобладают над глобулинами. Часть белка составляют ферменты - диастаза, липаза и глико-литические ферменты. Лимфоплазма содержит также нейтральные жиры, простые сахара, NaCl, Na2CO3 и другие, а также различные соединения, в состав которых входят кальций, магний, железо.
Форменные элементы лимфы представлены главным образом лимфоцитами (98 %), а также моноцитами и другими видами лейкоцитов, иногда в ней обнаруживаются эритроциты. Лимфа накапливается в лимфатических
капиллярах тканей и органов, куда под влиянием различных факторов, в частности осмотического и гидростатического давления, из тканей постоянно поступают различные компоненты лимфоплазмы. Из капилляров лимфа перемещается в периферические лимфатические сосуды, по ним - в лимфатические узлы, затем в крупные лимфатические сосуды и вливается в кровь. Состав лимфы постоянно меняется. Различают лимфупериферическую (до лимфатических узлов), промежуточную (после прохождения через лимфатические узлы) и центральную (лимфа грудного и правого лимфатического протоков). Процесс лимфообразования тесно связан с поступлением воды и других веществ из крови в межклеточные пространства и образованием тканевой жидкости.
7.4. КРОВЕТВОРЕНИЕ (ГЕМОПОЭЗ)
Гемопоэзом (haemopoesis) называют развитие крови. Различают эмбриональный гемопоэз, который происходит в эмбриональный период и приводит к развитию крови как ткани, и постэмбриональный гемопоэз, который представляет собой процесс физиологической регенерации крови.
Развитие эритроцитов называют эритропоэзом, развитие гранулоцитов - гранутоцитопоэзом, тромбоцитов - тромбоцитопоэзом, развитие моноцитов - моноцитопоэзом, развитие лимфоцитов и иммуноцитов - лимфоцито-и иммуноцитопоэзом.
7.4.1. Эмбриональный гемопоэз
В развитии крови как ткани в эмбриональный период можно выделить три основных этапа, последовательно сменяющих друг друга: 1)мезобластический, когда начинается развитие клеток крови во внезаро-дышевых органах - мезенхиме стенки желточного мешка и хориона (с 3-й по 9-ю нед развития зародыша человека) и появляется первая генерация стволовых клеток крови; 2) печеночный, который начинается в печени с 5-6-й нед развития зародыша, когда печень становится основным органом гемопоэза, в ней образуется вторая генерация СКК. Кроветворение в печени достигает максимума через 5 мес и завершается перед рождением. СКК печени заселяют вилочковую железу (здесь, начиная с 7-8-й нед, развиваются Т-лимфоциты), селезенку (гемопоэз начинается с 12-й нед) и лимфатические узлы (гемопоэз отмечается с 10-й нед); 3) медуллярный(костномозговой) - появление третьей генерации СКК в костном мозге, где гемопоэз начинается с 10-й нед и постепенно нарастает к рождению, а после рождения костный мозг становится центральным органом гемопоэза.
Кроветворение в стенке желточного мешка.У человека оно начинается в конце 2-й - начале 3-й нед эмбрионального развития. В мезенхиме стенки желточного мешка обособляются зачатки сосудистой крови, или
кровяные островки. В них мезенхимные клетки теряют отростки, округляются и преобразуются в стволовые клетки крови. Клетки, ограничивающие кровяные островки, уплощаются, соединяются между собой и образуют эндотелиальную выстилку будущего сосуда. Часть СКК дифференцируются в первичные клетки крови (бласты), крупные клетки с базофиль-ной цитоплазмой и ядром, в котором хорошо заметны крупные ядрышки (рис. 7.14). Большинство первичных кровяных клеток митотически делятся и превращаются в первичные эритробласты,характеризующиеся крупным размером (мегалобласты). Это превращение совершается в связи с накоплением эмбрионального гемоглобина в цитоплазме бластов, при этом сначала образуются полихроматофильные эритробласты, а затем ацидофильные эри-тробласты с большим содержанием гемоглобина. В некоторых первичных эритробластах ядра подвергаются кариорексису и удаляются из клеток, в других клетках ядра сохраняются. В результате образуются безъядерные и ядросодержащие первичные эритроциты, отличающиеся большим размером от ацидофильных эритробластов и поэтому получившие название мегало-цитов. Такой тип кроветворения называется мегалобластическим. Он характерен для эмбрионального периода, но может появляться в постнатальном периоде при некоторых заболеваниях (злокачественное малокровие).
Наряду с мегалобластическим в стенке желточного мешка начинается нормобластическое кроветворение, при котором из бластов образуются вторичные эритробласты; сначала по мере накопления в их цитоплазме гемоглобина они превращаются в полихроматофильные эритробласты, далее в нормобласты, из которых образуются вторичные эритроциты (нормоци-ты); размеры последних соответствуют эритроцитам (нормоцитам) взрослого человека (см. рис. 7.14, а). Развитие эритроцитов в стенке желточного мешка происходит внутри первичных кровеносных сосудов, т. е.интраваску-лярно. Одновременно экстраваскулярно из бластов, расположенных вокруг сосудов, дифференцируется небольшое количество гранулоцитов - ней-трофилов и эозинофилов. Часть СКК остается в недифференцированном состоянии и разносится током крови по различным органам зародыша, где происходит их дальнейшая дифференцировка в клетки крови или соединительной ткани. После редукции желточного мешка основным кроветворным органом временно становится печень.
Кроветворение в печени.Печень закладывается примерно на 3-4-й нед эмбрионального развития, а с 5-й нед она становится центром кроветворения. Кроветворение в печени происходит экстраваскулярно, по ходу капилляров, врастающих вместе с мезенхимой внутрь печеночных долек. Источником кроветворения в печени служат стволовые клетки крови, из которых образуются бласты, дифференцирующиеся во вторичные эритроциты. Процесс их образования повторяет описанные выше этапы образования вторичных эритроцитов. Одновременно с развитием эритроцитов в печени образуются зернистые лейкоциты, главным образом нейтрофильные и ацидофильные. В цитоплазме бласта, становящейся более светлой и менее базофильной, появляется специфическая зернистость, после чего ядро приобретает неправильную форму. Кроме гранулоцитов, в печени формируют-
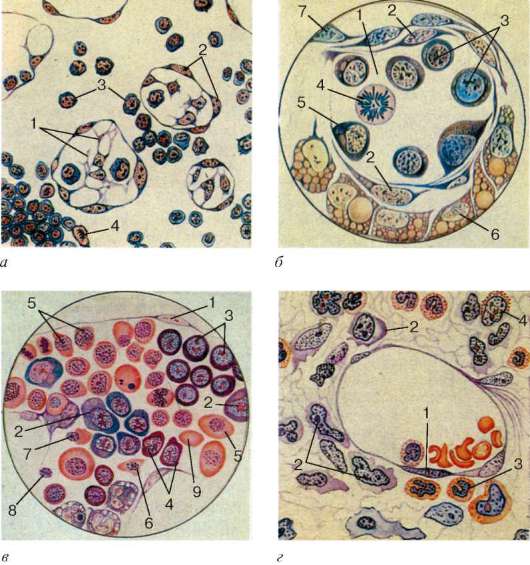
Рис. 7.14.Эмбриональный гемопоэз (по А. А. Максимову):
а - кроветворение в стенке желточного мешка зародыша морской свинки: 1 - мезенхимальные клетки; 2 - эндотелий стенки сосудов; 3 - первичные кровяные клетки-бласты; 4 - митотически делящиеся бласты; б - поперечный срез кровяного островка зародыша кролика 8,5 сут: 1 - полость сосуда; 2 - эндотелий; 3 - интра-васкулярные кровяные клетки; 4 - делящаяся кровяная клетка; 5 - формирование первичной кровяной клетки; 6 - энтодерма; 7 - висцеральный листок мезодермы; в - развитие вторичных эритробластов в сосуде зародыша кролика 13,5 сут: 1 - эндотелий; 2 - проэритробласты; 3 - базофильные эритробласты; 4 - поли-хроматофильные эритробласты; 5 - оксифильные (ацидофильные) эритробласты (нормобласты); 6 - оксифильный (ацидофильный) эритробласт с пикнотическим ядром; 7 - обособление ядра от оксифильного (ацидофильного) эритробласта (нор-мобласта); 8 - вытолкнутое ядро нормобласта; 9 - вторичный эритроцит; г - кроветворение в костном мозге зародыша человека с копчиково-теменной длиной тела 77 мм. Экстраваскулярное развитие клеток крови: 1 - эндотелий сосуда; 2 - бласты; 3 - нейтрофильные гранулоциты; 4 - эозинофильный миелоцит
ся гигантские клетки - мегакариоциты. К концу внутриутробного периода кроветворение в печени прекращается.
Кроветворение в тимусе.Вилочковая железа закладывается в конце 1-го мес внутриутробного развития, и на 7-8-й нед ее эпителий начинает заселяться стволовыми клетками крови, которые дифференцируются в лимфоциты тиму-
са. Увеличивающееся число лимфоцитов тимуса дает начало Т-лимфоцитам, заселяющим Т-зоны периферических органов иммунопоэза.
Кроветворение в селезенке.Закладка селезенки происходит в конце 1-го мес внутриутробного развития. Из вселяющихся в нее стволовых клеток происходит экстраваскулярное образование всех видов форменных элементов крови, т. е. селезенка в эмбриональном периоде представляет собой универсальный кроветворный орган. Образование эритроцитов и гранулоци-тов в селезенке достигает максимума на 5-м мес внутриутробного развития. После этого в ней начинает преобладать лимфоцитопоэз.
Кроветворение в лимфатических узлах.Первые закладки лимфатических узлов у человека появляются на 7-8-й нед эмбрионального развития. Большинство лимфатических узлов развиваются на 9-10-й нед. В этот же период начинается проникновение в лимфатические узлы стволовых клеток крови, из которых дифференцируются эритроциты, гранулоциты и мегака-риоциты. Однако формирование этих элементов быстро подавляется образованием лимфоцитов, составляющих основную часть клеток лимфатических узлов. Появление единичных лимфоцитов происходит уже на 8-15-й нед развития, однако массовое «заселение» лимфатических узлов предшественниками Т- и В-лимфоцитов начинается с 16-й нед, когда формируются посткапиллярные венулы, через стенку которых осуществляется процесс миграции клеток. Из клеток-предшественников дифференцируются лим-фобласты (большие лимфоциты), а далее средние и малые лимфоциты. Дифференцировка Т- и В-лимфоцитов происходит в Т- и В-зависимых зонах лимфатических узлов.
Кроветворение в костном мозге.Закладка костного мозга осуществляется на 2-м мес внутриутробного развития. Первые гемопоэтические элементы появляются на 12-й нед развития; в это время основную их массу составляют эритробласты и предшественники гранулоцитов. Из СКК в костном мозге формируются все форменные элементы крови, развитие которых происходит экстраваскулярно (см. рис. 7.14, г). Часть СКК сохраняются в костном мозге в недифференцированном состоянии, они могут расселяться по другим органам и тканям и являться источником развития клеток крови и соединительной ткани. Таким образом, костный мозг становится центральным органом, осуществляющим универсальный гемопоэз, и остается им в течение постнатальной жизни. Он обеспечивает стволовыми кроветворными клетками тимус и другие органы гемопоэза.
7.4.2. Постэмбриональный гемопоэз
Постэмбриональный гемопоэз представляет собой процесс физиологической регенерации крови (клеточное обновление), который компенсирует физиологическое разрушение дифференцированных клеток. Миелопоэз происходит в миелоидной ткани (textus myeloideus), расположенной в эпифизах трубчатых и полостях многих губчатых костей (см. главу 14). Здесь развиваются форменные элементы крови: эритроциты, гранулоциты, моноциты, кровяные пластинки, предшественники лимфоцитов. В миелоид-
ной ткани находятся стволовые клетки крови и соединительной ткани. Предшественники лимфоцитов постепенно мигрируют и заселяют такие органы, как тимус, селезенка, лимфатические узлы и др.
Лимфопоэз происходит в лимфоидной ткани (textus lymphoideus), которая имеет несколько разновидностей, представленных в тимусе, селезенке, лимфатических узлах. Она выполняет основные функции: образование Т- и В-лимфоцитов и иммуноцитов (плазмоцитов и др.).
СКК являются плюрипотентными (полипотентными) предшественниками всех клеток крови и относятся к самоподдерживающейся популяции клеток. Они редко делятся. Впервые представление о родоначальных клетках крови сформулировал в начале XX в. А. А. Максимов, который считал, что по своему строению они сходны с лимфоцитами. В настоящее время это представление нашло подтверждение и дальнейшее развитие в новейших экспериментальных исследованиях, проводимых главным образом на мышах. Выявление СКК стало возможным при применении метода коло-ниеобразования.
Экспериментально (на мышах) показано, что при введении смертельно облученным животным (утратившим собственные кроветворные клетки) взвеси клеток красного костного мозга или фракции, обогащенной СКК, в селезенке появляются колонии клеток - потомков одной СКК. Пролиферативную активность СКК модулируют колониестимулирующие факторы (КСФ), интерлейкины (ИЛ-3 и др.). Каждая СКК в селезенке образует одну колонию и называется селезеночной колониеобразующей единицей (КОЕ-С). Подсчет колоний позволяет судить о количестве стволовых клеток, находящихся во введенной взвеси клеток. Таким образом, было установлено, что у мышей на 105 клеток костного мозга приходится около 50 стволовых клеток. Исследование очищенной фракции стволовых клеток с помощью электронного микроскопа позволяет сделать вывод, что по ультраструктуре они очень близки к малым темным лимфоцитам.
Исследование клеточного состава колоний выявляет две линии их диф-ференцировки. Одна линия дает начало мультипотентной клетке - родоначальнику гранулоцитарного, эритроцитарного, моноцитарного и мега-кариоцитарного дифферонов гемопоэза (КОЕ-ГЭММ). Вторая линия дает начало мультипотентной клетке - родоначальнику лимфопоэза (КОЕ-Л) (рис. 7.15). Из мультипотентных клеток дифференцируются олигопотент-ные (КОЕ-ГМ) и унипотентные родоначальные (прогениторные) клетки. Методом колониеобразования определены родоначальные унипотентные клетки для моноцитов (КОЕ-М), нейтрофилов (КОЕ-Гн), эозинофилов (КОЕ-Эо), базофилов (КОЕ-Б), эритроцитов (БОЕ-Э и КОЕ-Э), мегака-риоцитов (КОЕ-МГЦ), из которых образуются клетки-предшественники (прекурсорные). В лимфопоэтическом ряду выделяют унипотентные клетки - предшественники В-лимфоцитов и соответственно Т-лимфоцитов. Полипотентные (плюрипотентные и мультипотентные), олигопотентные и унипотентные клетки морфологически не различаются.
Все приведенные выше стадии развития клеток составляют четыре основных компартмента: I - стволовые клетки крови (плюрипотентные, полипо-
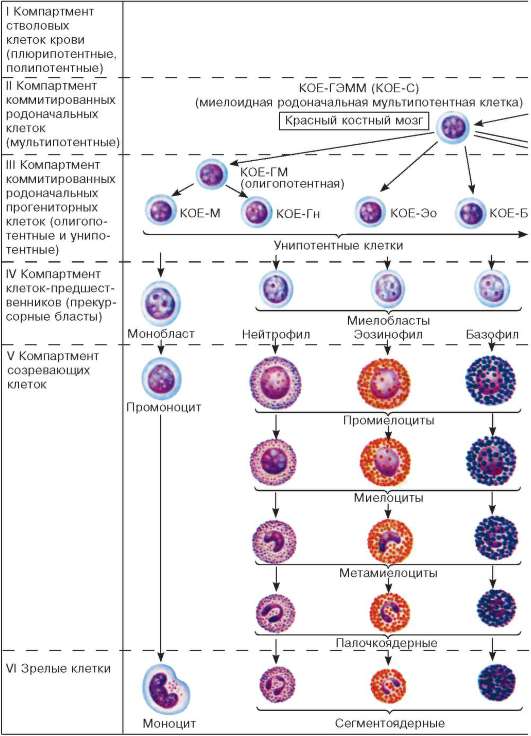
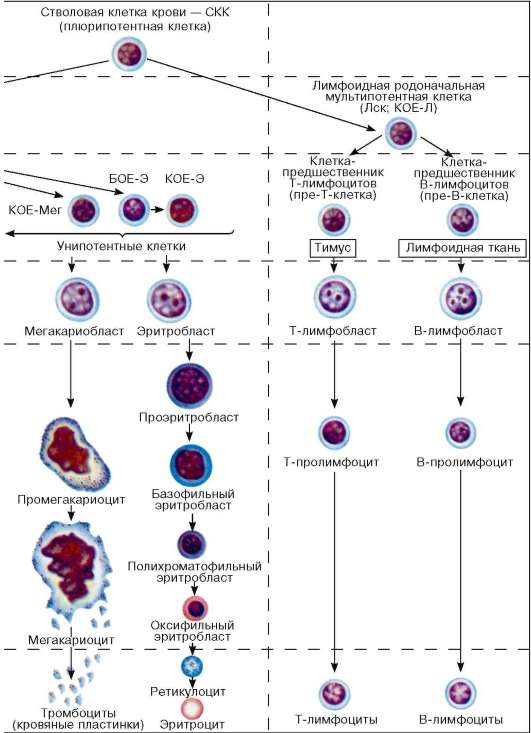
Рис. 7.15.Постэмбриональный гемопоэз, окраска азуром II-эозином (по Н. А. Юриной).
Стадии дифференцировки крови: I-IV - морфологически неидентифицируе-мые клетки; V, VI - морфологически идентифицируемые клетки. Б - базофил;
БОЕ - бурстобразующая единица; Г - гранулоциты; Гн - гранулоцит нейтрофильный; КОЕ - колониеобразующие единицы; КОЕ-С - селезеночная колониеобразующая единица; Л - лимфоцит; Лск - лимфоидная стволовая клетка; М - моноцит; Мег - мегакариоцит; Эо - эозинофил; Э - эритроцит. Ретикулоцит окрашен суправитально
тентные); II - коммитированные родоначальные клетки (мультипотентные); III - коммитированные родоначальные (прогенторные) олигопотентные и унипотентные клетки; IV - клетки-предшественники (прекурсорные).
Дифференцировка полипотентных клеток в унипотентные определяется действием ряда специфических факторов - эритропоэтинов (для эритро-бластов), гранулопоэтинов (для миелобластов), лимфопоэтинов (для лим-фобластов), тромбопоэтинов (для мегакариобластов) и др.
Из каждой клетки-предшественника образуется конкретный вид клеток. Клетки каждого вида при созревании проходят ряд стадий и в совокупности образуют компартмент созревающих клеток (V). Зрелые клетки представляют последний компартмент (VI). Все клетки V и VI компартментов морфологически можно идентифицировать (рис. 7.15).
Эритроцитопоэз
Родоначальником эритроидных клеток человека, как и других клеток крови, является полипотентная стволовая клетка крови, способная формировать в культуре костного мозга колонии. Полипотентная СКК в результате дивергентной дифференцировки дает два типа мультипотентных частично коммитированных кроветворных клеток: 1) коммитированные к лимфо-идному типу дифференцировки (Лск, КОЕ-Л); 2) КОЕ-ГЭММ - единицы, образующие смешанные колонии, состоящие из гранулоцитов, эритроцитов, моноцитов и мегакариоцитов (аналог КОЕ-С in vitro). Из второго типа мультипотентных кроветворных клеток дифференцируются унипотентные единицы: бурстобразующая (БОЕ-Э) и колониеобразующая (КОЕ-Э) эри-троидные клетки, которые являются коммитированными родоначальными клетками эритропоэза.
БОЕ-Э - взрывообразующая, или бурстобразующая, единица (burst - взрыв) по сравнению с КОЕ-Э является менее дифференцированной. БОЕ-Э может при интенсивном размножении быстро образовать крупную колонию клеток. БОЕ-Э в течение 10 сут осуществляет 12 делений и образует колонию из 5000 эритроцитарных клеток с незрелым фетальным гемоглобином (HbF). БОЕ-Э малочувствительна к эритропоэтину и вступает в фазу размножения под влиянием интерлейкина-3 (бурстпромоторная активность), вырабатываемого моноцитами - макрофагами и Т-лимфоцитами. Интерлейкин-3 (ИЛ-3) является гликопротеином с молекулярной массой 20-30 килодальтон. Он активирует ранние полипотентные СКК, обеспечивая их самоподдержание, а также запускает дифференцировку полипотент-ных клеток в коммитированные клетки. ИЛ-3 способствует образованию клеток (КОЕ-Э), чувствительных к эритропоэтину.
КОЕ-Э по сравнению с БОЕ-Э - более зрелая клетка. Она чувствительна к эритропоэтину, под влиянием которого размножается (в течение 3 сут делает 6 делений), формирует более мелкие колонии, состоящие примерно из 60 эри-троцитарных элементов. Количество эритроидных клеток, образуемых в сутки из КОЕ-Э, в 5 раз меньше аналогичных клеток, образуемых из БОЕ-Э.
Таким образом, БОЕ-Э содержат клетки-предшественники эритроцитов, которые способны генерировать тысячи эритроидных прекурсоров
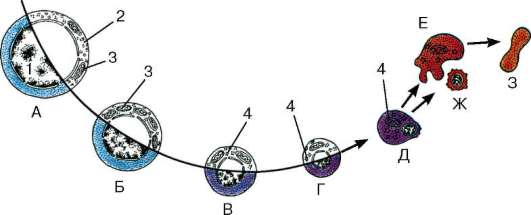
Рис. 7.16.Последовательные стадии дифференцировки проэритробласта в эритроцит: А - проэритробласт; Б - базофильный эритробласт; В - полихроматофильный эритробласт; Г - ацидофильный эритробласт (нормобласт); Д - выталкивание ядра из ацидофильного эритробласта; Е - ретикулоцит; Ж - пикнотичное ядро; З - эритроцит. 1 - ядро; 2 - рибосомы и полирибосомы; 3 - митохондрии; 4 - гранулы гемоглобина
(предшественников). Они содержатся в малом количестве в костном мозге и крови благодаря частичному самоподдержанию и миграции из компарт-мента мультипотентных кроветворных клеток. КОЕ-Э является более зрелой клеткой, образующейся из пролиферирующей БОЕ-Э.
Эритропоэтин - гликопротеиновый гормон, образующийся в юкста-гломерулярном аппарате (ЮГА) почки (90 %) и печени (10 %) в ответ на снижение парциального давления кислорода в крови (гипоксия) и запускающий эритропоэз из КОЕ-Э. Под его влиянием КОЕ-Э дифференцируются в проэритробласты, из которых образуются эритробласты (базофиль-ные, полихроматофильные, ацидофильные), ретикулоциты и эритроциты. Образующиеся из КОЕ-Э эритроидные клетки морфологически идентифицируются (рис. 7.16). Сначала образуется проэритробласт.
Проэритробласт - клетка диаметром 14-18 мкм, имеющая большое круглое ядро с мелкозернистым хроматином, одно-два ядрышка, слабобазо-фильную цитоплазму, в которой содержатся свободные рибосомы и полисомы, слаборазвитые комплекс Гольджи и гранулярная эндоплазматическая сеть. Базофильный эритробласт - клетка меньшего размера (13-16 мкм). Его ядро содержит больше гетерохроматина. Цитоплазма клетки обладает хорошо выраженной базофильностью в связи с накоплением в ней рибосом, в которых начинается синтез Нb.Полихроматофильный эритробласт - клетка размером 10-12 мкм. Ее ядро содержит много гетерохроматина. В цитоплазме клетки накапливается синтезируемый на рибосомах НЬ, окрашивающийся эозином, благодаря чему она приобретает серовато-фиолетовый цвет. Проэритробласты, базофильные и полихроматофильные эритробла-сты способны размножаться путем митоза, поэтому в них часто видны фигуры деления.
Следующая стадия дифференцировки - образование ацидофильного (оксифилия) эритробласта (нормобласта). Это клетка небольшого размера (8-10 мкм), имеющая маленькое пикнотичное ядро. В цитоплазме эритро-
бласта содержится много НЬ, обеспечивающего ее ацидофилию (оксифи-лию) - окрашивание эозином в ярко-розовый цвет. Пикнотическое ядро выталкивается из клетки, в цитоплазме сохраняются лишь единичные органеллы (рибосомы, митохондрии). Клетка утрачивает способность к делению.
Ретикулоцит - постклеточная структура (безъядерная клетка) с небольшим содержанием рибосом, обусловливающих наличие участков базофи-лии, и преобладанием НЬ, что в целом дает многоцветную (полихромную) окраску (поэтому эта клетка получила название «полихроматофильный эритроцит»). При выходе в кровь ретикулоцит созревает в эритроцит в течение 1-2 сут. Эритроцит - это клетка, образующаяся на конечной стадии дифференцировки клеток эритроидного ряда. Период образования эритроцита, начиная со стадии проэритробласта, занимает 7 сут.
Таким образом, в процессе эритропоэза происходят уменьшение размера клетки в 2 раза (см. рис. 7.16); уменьшение размера и уплотнение ядра и его выход из клетки; уменьшение содержания РНК, накопление НЬ, сопровождаемые изменением окраски цитоплазмы - от базофильной до полихро-матофильной и ацидофильной; потеря способности к делению клетки. Из одной СКК в течение 7-10 сут в результате 12 делений образуется около 2000 зрелых эритроцитов.
Эритропоэз у млекопитающих и человека протекает в костном мозге в особых морфофункциональных ассоциациях, получивших название эри-тробластических островков, впервые описанных французским гематологом М. Бесси (1958). Эритробластический островок состоит из макрофага, окруженного одним или несколькими слоями эритроидных клеток, развивающихся из унипотентной КОЕ-Э, вступившей в контакт с макрофагом КОЕ-Э. Образующиеся из нее клетки (от проэритробласта до ретикулоцита) удерживаются в контакте с макрофагом его рецепторами (сиалоадгезинами и др.) (рис. 7.17, 7.18).
У взрослого организма потребность в эритроцитах обычно обеспечивается за счет усиленного размножения полихроматофильных эритробластов (гомопластический гемопоэз). Однако, когда потребность организма в эритроцитах возрастает (например, при потере крови), эритробласты начинают развиваться из предшественников, а последние - из стволовых клеток (гетеропластический эритропоэз).
В норме из костного мозга в кровь поступают только эритроциты и рети-кулоциты.
Гранулоцитопоэз
Источниками гранулоцитопоэза являются также СКК и мультипотент-ные КОЕ-ГЭММ (см. рис. 7.15). В результате дивергентной дифференци-ровки через ряд промежуточных стадий в трех различных направлениях образуются гранулоциты трех видов: нейтрофилы, эозинофилы и базофилы. Клеточные диффероны для гранулоцитов представлены следующими формами: СКК → КОЕ-ГЭММ → КОЕ-ГМ → унипотентные предшественники (КОЕ-Б, КОЕ-Эо, КОЕ-Гн) → миелобласт → промиелоцит → миелоцит →
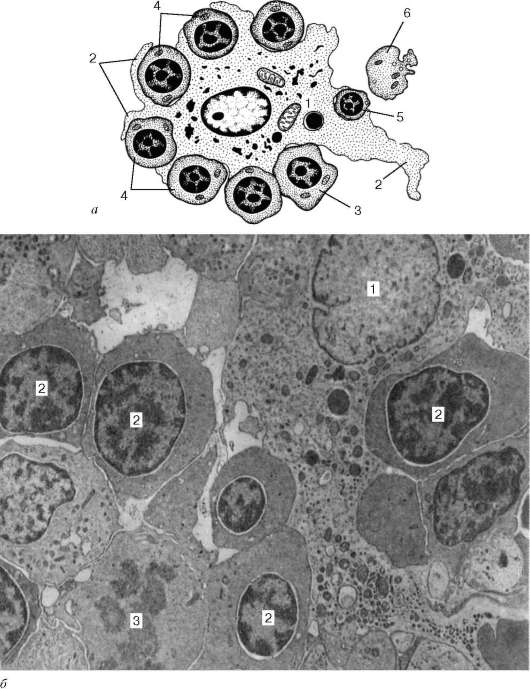
Рис. 7.17.Динамика развития эритробластического островка (по М. Бесси и соавт., с изменениями):
а - схема: 1 - цитоплазма макрофага; 2 - отростки макрофага; 3 - базофильные эритробласты; 4 - полихроматофильные эритробласты; 5 - ацидофильный эритро-бласт; 6 - ретикулоцит; б - срез эритроидного островка: 1 - макрофаг; 2 - эритроциты; 3 - митотически делящийся эритробласт. Электронная микрофотография по Ю. М. Захарову. Увеличение 8000
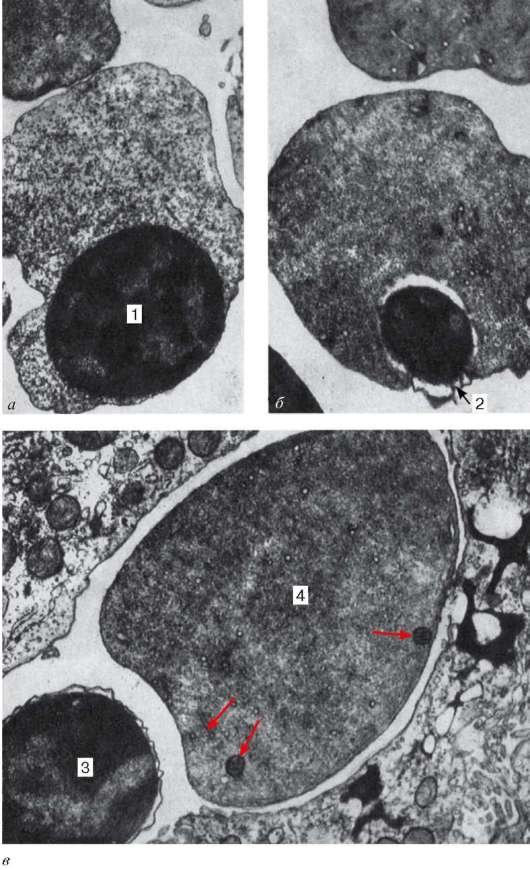
Рис. 7.18.Развитие эритроцитов в печени плода человека:
а, б - 15-недельный плод (увеличение 6000); в - 20-недельный плод (увеличение 15 000). 1 - эксцентрично расположенное ядро эритробласта; 2 - обособление пикнотического ядра ацидофильного эритробласта; 3 - отделение пикнотического ядра с узким ободком цитоплазмы от ацидофильного эритробласта; 4 - ретикулоцит с единичными органеллами (указано стрелками). Электронная микрофотография (по Замбони)
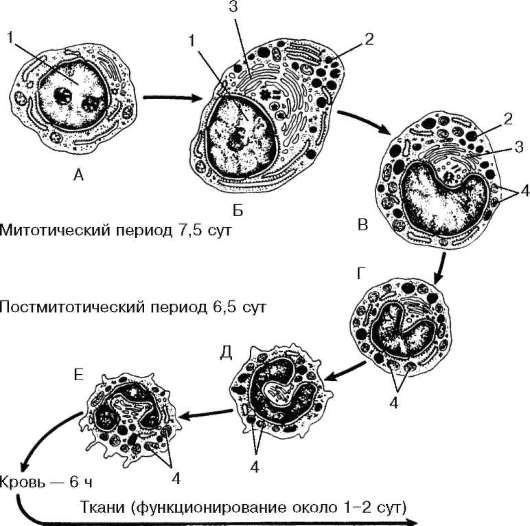
Рис. 7.19.Дифференцировка нейтрофильного гранулоцита в костном мозге (по Д. Байнтону, М. Фарквару, Дж. Элиоту, с изменениями):
А - миелобласт; Б - промиелоцит; В - миелоцит; Г - метамиелоцит; Д - палоч-коядерный нейтрофильный гранулоцит (нейтрофил); Е - сегментоядерный нейтрофильный гранулоцит. 1 - ядро; 2 - первичные (азурофильные) гранулы; 3 - комплекс Гольджи; 4 - вторичные - специфические гранулы
метамиелоцит → палочкоядерный гранулоцит → сегментоядерный гранулоцит.
По мере созревания гранулоцитов клетки уменьшаются в размерах, изменяется форма их ядер от округлой до сегментированной, в цитоплазме накапливается специфическая зернистость (рис. 7.19).
Миелобласты (myeloblastus), дифференцируясь в направлении того или иного гранулоцита, дают начало промиелоцитам (promyelocytus) (см. рис. 7.15). Это крупные клетки, содержащие овальное или круглое светлое ядро, в котором имеется несколько ядрышек. Около ядра располагается ясно выраженная центросома, хорошо развиты комплекс Гольджи, лизосомы. Цитоплазма слегка базофильна. В ней накапливаются первичные (азуро-фильные) гранулы, которые характеризуются высокой активностью мие-лопероксидазы, а также кислой фосфатазы, т. е. относятся к лизосомам. Промиелоциты делятся митотически. Специфическая зернистость отсутствует.
Нейтрофильные миелоциты (myelocytus neutrophilicus) имеют размер от 12 до 18 мкм. Эти клетки размножаются митозом. Цитоплазма их становится диффузно ацидофильной, в ней появляются наряду с первичными вторичные (специфические) гранулы, характеризующиеся меньшей электронной плотностью. В миелоцитах обнаруживаются все органеллы. Количество митохондрий невелико. Эндоплазматическая сеть состоит из пузырьков. Рибосомы располагаются на поверхности мембранных пузырьков, а также диффузно в цитоплазме. По мере размножения нейтрофильных миелоцитов круглое или овальное ядро становится бобовидным, начинает окрашиваться темнее, хроматиновые глыбки становятся грубыми, ядрышки исчезают.
Такие клетки уже не делятся. Это метамиелоциты (metamyelocytus) (см. рис. 7.19). В цитоплазме увеличивается число специфических гранул. Если метамиелоциты встречаются в периферической крови, то их называют юными формами. При дальнейшем созревании их ядро приобретает вид изогнутой палочки. Подобные формы получили название палочкоядерных гранулоцитов. Затем ядро сегментируется, и клетка становитсясегментоядер-ным нейтрофильным гранулоцитом. Полный период развития нейтрофильного гранулоцита составляет около 14 сут, при этом период пролиферации продолжается около 7,5 сут, а постмитотический период дифференцировки - около 6,5 сут.
Эозинофильные (ацидофильные) миелоциты (см. рис. 7.15) представляют собой клетки округлой формы диаметром (на мазке) около 14-16 мкм. По характеру строения ядра они мало отличаются от нейтрофильных миелоци-тов. Цитоплазма их заполнена характерной эозинофильной зернистостью. В процессе созревания миелоциты митотически делятся, а ядро приобретает подковообразную форму. Такие клетки называютсяацидофильными мета-миелоцитами. Постепенно в средней части ядро истончается и становится двудольчатым, в цитоплазме увеличивается количество специфических гранул. Клетка утрачивает способность к делению.
Среди зрелых форм различают палочкоядерные и сегментоядерные эозино-фильные гранулоциты с двудольчатым ядром.
Базофильные миелоциты (см. рис. 7.15) встречаются в меньшем количестве, чем нейтрофильные или эозинофильные миелоциты. Размеры их примерно такие же, как и эозинофильных миелоцитов; ядро округлой формы, без ядрышек, с рыхлым расположением хроматина. Цитоплазма базофильных миелоцитов содержит в широко варьирующих количествах специфические базофильные зерна неодинаковых размеров, которые проявляют мета-хромазию при окрашивании азуром и легко растворяются в воде. По мере созревания базофильный миелоцит превращается вбазофильный метамиелоцит, а затем в зрелый базофильный гранулоцит.
Все миелоциты, особенно нейтрофильные, обладают способностью фагоцитировать, а начиная с метамиелоцита, приобретают подвижность.
У взрослого организма потребность в лейкоцитах обеспечивается за счет размножения миелоцитов. При кровопотерях, например, миелоциты начинают развиваться из миелобластов, а последние из унипотентных и поли-потентных СКК.
Мегакариоцитопоэз. Тромбоцитопоэз
Кровяные пластинки образуются в костном мозге из мегакариоцитов - гигантских по величине клеток, которые дифференцируются из СКК, проходя ряд стадий. Последовательные стадии развития можно представить следующим клеточным диффероном: СКК → КОЕ-ГЭММ → КОЕ-МГЦ → мегакариобласт → промегакариоцит → мегакариоцит → тромбоциты (кровяные пластинки). Весь период образования пластинок составляет около 10 сут (см. рис. 7.15).
Мегакариобласт (megacaryoblastus) - клетка диаметром 15-25 мкм, имеет ядро с инвагинациями и относительно небольшой ободок базофильной цитоплазмы. Клетка способна к делению митозом, иногда содержит два ядра. При дальнейшей дифференцировке утрачивает способность к митозу и делится путем эндомитоза, при этом увеличиваются плоидность и размер ядра.
Промегакариоцит (promegacaryocytus) - клетка диаметром 30-40 мкм, содержит полиплоидные ядра - тетраплоидные, октаплоидные (4 n, 8 n), несколько пар центриолей. Объем цитоплазмы возрастает, в ней начинают накапливаться азурофильные гранулы. Клетка также способна к эндоми-тозу и дальнейшему увеличению плоидности ядер.
Мегакариоцит (megacaryocytus) - дифференцированная форма. Среди мегакариоцитов различают резервные клетки, не образующие пластинок, и зрелые активированные клетки, образующие кровяные пластинки. Резервные мегакариоциты диаметром 50-70 мкм, имеют очень большое, дольчатое ядро с набором хромосом 16-32 n; в их цитоплазме имеются две зоны - околоядерная, содержащая органеллы и мелкие азурофильные гранулы, и наружная (эктоплазма) - слабобазофильная, в которой хорошо развиты элементы цитоскелета. Зрелый, активированный мегакариоцит - крупная клетка диаметром 50-70 мкм (иногда даже до 100 мкм). Содержит очень крупное, сильно дольчатое полиплоидное ядро (до 64 n). В ее цитоплазме накапливается много азурофильных гранул, которые объединяются в группы. Прозрачная зона эктоплазмы также заполняется гранулами и вместе с плазмолеммой формирует псевдоподии в виде тонких отростков, направленных к стенкам сосудов. В цитоплазме мегакариоцита наблюдается скопление линейно расположенных пузырьков, которые разделяют зоны цитоплазмы с гранулами. Из пузырьков формируются демаркационные мембраны, разделяющие цитоплазму мегакариоцита на участки диаметром 1-3 мкм, содержащие по 1-3 гранулы (будущие кровяные пластинки). В цитоплазме можно выделить три зоны - перинуклеарную, промежуточную и наружную. В наружной зоне цитоплазмы наиболее активно идут процессы демаркации, формирования протромбоцитарных псевдоподий, проникающих через стенку синусов в их просвет, где и происходит отделение кровяных пластинок (рис. 7.20). После отделения пластинок остается клетка, содержащая дольчатое ядро, окруженное узким ободком цитоплазмы, - резидуальный мегакариоцит, который затем подвергается разрушению. При уменьшении числа кровяных пластинок в крови (тромбоцитопения), например после кровопотери, отмечается усиление мегакариоцитопоэза, приво-
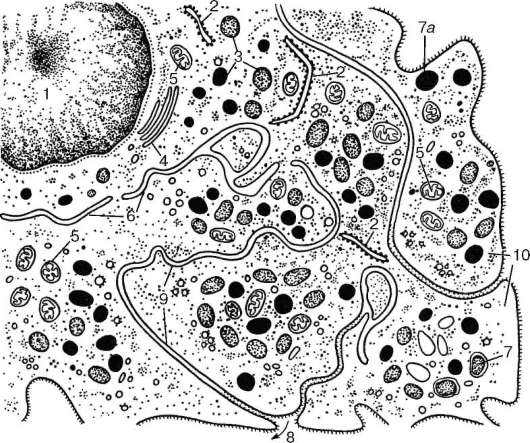
Рис. 7.20.Ультрамикроскопическое строение мегакариоцита (по Н. А. Юриной, Л. С. Румянцевой):
1 - ядро; 2 - гранулярная эндоплазматическая сеть; 3 - гранулы; 4 - комплекс Гольджи; 5 - митохондрии; 6 - гладкая эндоплазматическая сеть; 7 - альфа-гранулы; 7а - лизосомы; 8 - инвагинация плазмолеммы; 9 - демаркационные мембраны; 10 - формирующиеся кровяные пластинки
дящее к увеличению количества мегакариоцитов в 3-4 раза с последующей нормализацией числа тромбоцитов в крови.
Моноцитопоэз
Образование моноцитов происходит из стволовых клеток костного мозга по схеме: СКК → КОЕ-ГЭММ → КОЕ-ГМ → унипотентный предшественник моноцита (КОЕ-М) → монобласт (monoblastus) → промоноцит → моноцит (monocytus). Моноциты из крови поступают в ткани, где являются источником развития различных видов макрофагов.
Лимфоцитопоэз и иммуноцитопоэз
Лимфоцитопоэз проходит следующие стадии: СКК → КОЕ-Л (лимфоидная родоначальная мультипотентная клетка) → унипотентные предшественники лимфоцитов (пре-Т-клетки и пре-В-клетки)→ лимфобласт (lymphoblastus) →пролимфоцит → лимфоцит. Особенность лимфоцитопоэ-за - способность дифференцированных клеток (лимфоцитов) дедифферен-цироваться в бластные формы.
Процесс дифференцировки Т-лимфоцитов в тимусе приводит к образованию из унипотентных предшественников Т-бластов, из которых формируются эффекторные лимфоциты - киллеры, хелперы, супрессоры.
Дифференцировка унипотентных предшественников В-лимфоцитов в лимфоидной ткани ведет к образованию плазмобластов (plasmoblastus),затем проплазмоцитов, плазмоцитов (plasmocytus). Более подробно процессы образования иммунокомпетентных клеток описаны в главе 14.
Регуляция гемопоэза
Кроветворение регулируется факторами роста, обеспечивающими пролиферацию и дифференцировку СКК и последующих стадий их развития, факторами транскрипции, влияющими на экспрессию генов, определяющих направление дифференцировки гемопоэтических клеток, а также витаминами, гормонами.
Факторы роста включают колониестимулирующие факторы , интерлей-кины и ингибирующие факторы. Они являются гликопротеинами с молекулярной массой около 20 килодальтон. Гликопротеины действуют и как циркулирующие гормоны, и как местные медиаторы, регулирующие гемопоэз и развитие клеточных дифферонов. Они почти все действуют на СКК, КОЕ, коммитированные и зрелые клетки. Однако отмечаются индивидуальные особенности действия этих факторов на клетки-мишени.
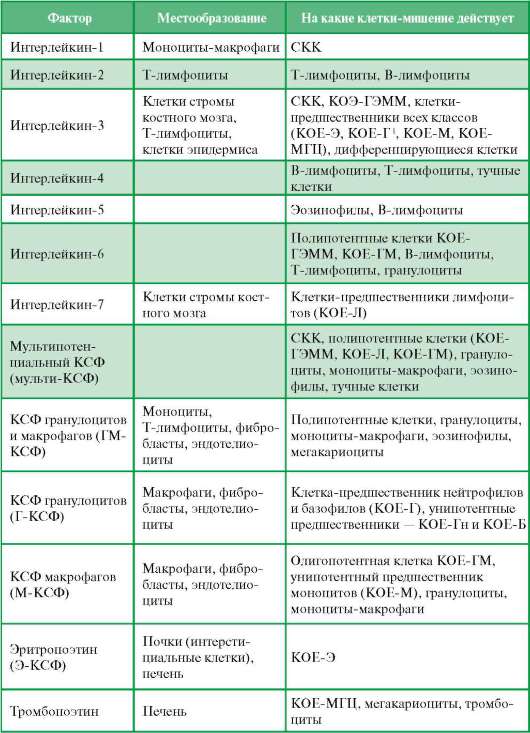
Например, фактор роста стволовых клеток влияет на пролиферацию и миграцию СКК в эмбриогенезе. В постнатальном периоде на гемопоэз оказывают влияние несколько КСФ, среди которых наиболее изучены факторы, стимулирующие развитие гранулоцитов и макрофагов (ГМ-КСФ, Г-КСФ, М-КСФ), а также интерлейкины.
Как видно из табл. 7.1, мульти-КСФ и интерлейкин-3 действуют на поли-потентную стволовую клетку и большинство КОЕ. Некоторые КСФ могут действовать на одну или более стадий гемопоэза, стимулируя деление, диф-ференцировку клеток или их функцию. Большинство указанных факторов выделено и применяется для лечения различных болезней. Для получения их используются биотехнологические методы.
Большая часть эритропоэтина образуется в почках (интерстициальные клетки), меньшая - в печени. Его образование регулируется содержанием в крови О2, которое зависит от количества циркулирующих в крови эритроцитов. Снижение числа эритроцитов и соответственно парциального давления кислорода (Ро2) является сигналом для увеличения продукции эритропоэтина. Эритропоэтин действует на чувствительные к нему КОЕ-Э, стимулируя их пролиферацию и дифференцировку, что в конечном итоге приводит к повышению содержания в крови эритроцитов. К факторам роста для эритроидных клеток, кроме эритропоэтина, относится фактор бурст-промоторной активности (БПА), который влияет на БОЕ-Э. БПА образуется клетками ретикулоэндотелиальной системы. В настоящее время считают, что он является интерлейкином-3.
Тромбопоэтин синтезируется в печени, стимулирует пролиферацию КОЕ-МГЦ, их дифференцировку и образование тромбоцитов.
Ингибирующие факторы дают противоположный эффект, т. е. тормозят гемопоэз. К ним относятся липопротеины, блокирующие действие КСФ (лактофер-рин, простагландины, интерферон, кейлоны). Гормоны также влияют на гемопоэз. Например, гормон роста стимулирует эритропоэз, глюкокортикоиды, напротив, подавляют развитие клеток-предшественников.
Таблица 7.1.Гемопоэтические факторы роста (стимуляторы)
1 Нейтрофилы, эозинофилы, базофилы.
Витамины необходимы для стимуляции пролиферации и дифференцировки гемо-поэтических клеток. Витамин В12 потребляется с пищей и поступает с кровью в костный мозг, где влияет на гемопоэз. Нарушение процесса всасывания при различных заболеваниях может служить причиной дефицита витамина В12 и нарушений в гемопоэ-зе. Фолиевая кислота участвует в синтезе пуриновых и пиримидиновых оснований.
Таким образом, развитие кроветворных клеточных дифферонов протекает в неразрывной связи с микроокружением. Миелоидная и лимфоидная ткани являются разновидностями соединительной ткани, т. е. относятся к тканям внутренней среды. Ретикулоцитарный, адипоцитарный, тучнокле-точный и остеобластический диффероны вместе с межклеточным веществом (матриксом) формируют микроокружение для гемопоэтических диф-феронов. Гистологические элементы микроокружения и гемопоэтические клетки функционируют в неразрывной связи. Микроокружение оказывает воздействие на дифференцировку клеток крови (при контакте с их рецепторами или путем выделения специфических факторов). В миелоидной и лимфоидной тканях стромальные ретикулярные и гемопоэтические элементы образуют единое функциональное целое. В тимусе имеется сложная строма, представленная как соединительнотканными, так и ретикулоэпи-телиальными клетками. Эпителиальные клетки секретируют особые вещества - тимозины, оказывающие влияние на дифференцировку из СКК Т-лимфоцитов. В лимфатических узлах и селезенке специализированные ретикулярные клетки создают микроокружение, необходимое для пролиферации и дифференцировки в специальных Т- и В-зонах Т- и В-лимфоцитов и плазмоцитов.
Дата добавления: 2015-11-12; просмотров: 5641;
