Теплоемкость. Энтальпия
Теплоемкость
Удельная теплоемкость вещества – количество теплоты, которое необходимо передать телу, чтобы тело массой 1 кг нагрелось 1 К.

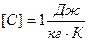
Молярная теплоемкость – величина равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К.
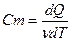
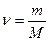
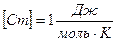
Молярная теплоемкость связана с удельной
 |
Cm = cM
Запишем первое начало термодинамики
Cm dT = dυm + pdVm
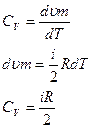
| 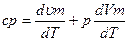 - не зависит от вида процесса
сp = cv + R - не зависит от вида процесса
сp = cv + R
|
Уравнение Майера
Удельная теплоемкость при постоянном давлении всегда больше удельной теплоемкости при постоянном объеме.
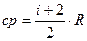 , где i – число степеней свободы
, где i – число степеней свободы
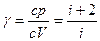 .
.
При низких температурах наблюдается только поступательное движение молекул, при компактных – добавляется вращение, при высоких добавляется колебание молекул.
Отношение теплоты Q, полученное телом в изотермическом процессе, к температуре Т теплоотдающего тела, называется приведенным количеством теплоты.
Приведенное количество теплоты, сообщаемое телу на бесконечно малом участке процесса, равно  .
.
Приведенное количество теплоты, сообщаемое телу в любом обратном круговом процессе, равно нулю:

 - функция, которая определяется только состоянием системы и не зависит от пути, каким системам пришла в это состояние.
- функция, которая определяется только состоянием системы и не зависит от пути, каким системам пришла в это состояние.
Функция состояния, дифференциалом которой является  называется энтропия.
называется энтропия.
Для обратимых процессов изменение энтропии ∆S = 0.
Энтропия системы, совершающий необратимый цикл, возрастает ∆S > 0.
Если система обливается теплотой с внешней средой, то энтропия может вести себя любым образом ∆S ≥ 0.
Энтропия замкнутой системы может либо возрастать (в случае обратимых процессов), либо оставаться постоянной (в случае обратимых процессов).

Физический смысл имеет разность энтропий.
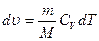 ,
, 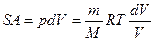
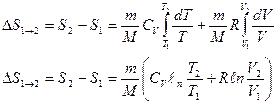
Изменение энтропии ∆S1→2 идеального газа при переходе его из состояния 2 не зависит от вида процесса перехода 1→2.
Для адиабатического процесса dQ = 0 ∆S = 0, S = const, т.е адиабатический процесс протекает при постоянной энтропии.
При изотермическом процессе

Все процессы в замкнутой системе ведут к увеличению ее энтропии.
Второе начало термодинамики.
Возможны лишь такие процессы, происходящие в макроскопической системе, которые ведут к увеличению энтропии.
Гипотеза о тепловой смерти Вселенной
Энтропия Вселенной должна достичь своего максимума. Все формы движения должны перейти в тепловую.
Переход от горячих тел к холодильным приведен к тому, что температурах всех тел во Вселенной сравняется, т.е. наступит полное тепловое равновесие и все процессы во Вселенной прекратятся – наступит тепловая смерть Вселенной.
Ошибочность вывода заключается в том, что второе начало термодинамики нельзя применять к незамкнутым системам.
Физический смысл энтропии
Термодинамическая вероятность – это число способов, которыми может быть реализовано данное состояние макроскопической системы, или число микросостояний, осуществляющих данное макросостояние
S = K ℓn W – формула Больцмана.
Энтропия, определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние.
Энтропия является мерой неупорядоченности системы.
Второе начало термодинамики
(другая формулировка)
При необратимых процессах, происходящих в замкнутой системе, вероятность состояния системы возрастает, при обратимых процессах.
Дата добавления: 2015-11-10; просмотров: 1572;
