Лекция 8. Титриметрический (объемный) анализ. Способы выражения концентра-ции растворов. Посуда и приборы в объемном анализе.
Титриметрический анализ (объемный анализ) — метод количественного анализа, осно-ванный на измерении объема или массы реагента, требующегося для реакции с исследуемым ве-ществом, раздел аналитической химии. Титриметрический анализ широко применяется в био-химических, клинических, санитарно-гигиенических и других лабораториях в эксперименталь-ных исследованиях и для клинических анализов.
Титрированный (стандартный, рабочий) раствор- это раствор реагента с точно известной концентрацией, который используют для реакции с раствором анализируемым веществом. Титрование – процесс приливания стандартного раствора к исследуемому раствору вещества.(конец титрования, момент протекания химической реакции)- момент, Точка эквивалентности когда количества веществ соответствуют необходимому для протекания химической реакции между ними: растворение или образование осадка, изменение окраски раствора, выделение газо-образного вещества или большого количества теплоты; нередко при реакции прозрачных растворов используют индикаторы.
К реакциям, используемым при титриметрическом анализе, предъявляются следующие требования: вещества должны реагировать в строго количественных (стехиометрических) отно-шениях без побочных реакций, реакции должны протекать быстро и практически до конца; для установления точки эквивалентности необходимо применять достаточно надежные способы, влияние посторонних веществ на ход реакции должно быть исключено. Кроме того, желательно, чтобы при титриметрическом анализе реакции протекали при комнатной температуре.
Операция объемного анализа
1. Приготовление стандартного раствора.
2. Выбор индикатора.
3. Установление титра и нормальной концентрации стандартного раствора.
4. Титрование раствора, анализирующего вещества стандартным раствором.
5. Вычисление результатов анализа.
Классификация титриметрических методов анализа в зависимости от типа химической реакции:
1. Метод нейтрализации (кислотно-основное титрирование).
2. Окислительно-восстановительного титрирования (редоксеметря).
3. Метод осаждения.
4. Метод комплексообразования (комплексонометрия).
Измерительная посуда и ее назначение: бюретки- стеклянная градуированная трубка с дозатором для определения объема затраченного стандартного раствора , пипетки для забора оп-ределенного количества раствора, колбы для титрования и мерные цилиндры для отмеривания определенного объема раствора
Способы выражения концентрации растворов:
1) Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m или отношение массы рас-творенного вещества к произведению плотности раствора и объема:
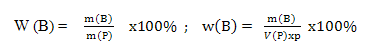
2) Молярная концентрация Cм(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора (М; моль/л). 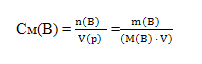
где М(B) - молярная масса растворенного вещества г/моль, m(B)- масса вещества, г; V- объем раствора, л.
3) Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
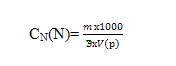
Где m - масса вещества, г; V(р)- объем растовра,л; Э- эквивалент вещества. Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп Экислоты = Мкислоты / число замещаемых в реакции атомов водорода Эсоли = Мсоли / произведение числа катионов на его заряд.
4) Титр – отношение массы растворенного вещества к объему раствора (г/мл); отношение произведения нормальной концентрации и объема раствора на 1000. 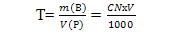
Расчеты в объемном анализе: отношение объемов растворов реагирующих веществ равно обратному отношению их нормальных концентраций. 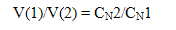
Вопросы для самопроверки:
1. В чем сущность титриметрического объема?
2. Что такое титрование?
3. Что такое стандартный раствор, в чем его роль?
4. Сущность точки эквивалентности?
5. Почему при титриметрическом анализе часто используют индикаторы?
6. Какой измерительной посудой пользуются при титровании?
7. Перечислить способы выражения концентраций растворов.
8. Что такое эквивалент, способы его вычисления.
Дата добавления: 2015-11-10; просмотров: 5361;
