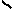Охрана окружающей среды от загрязнения нефтепродуктами
К числу наиболее вредных химических загрязнителей относят нефть и нефтепродукты. Нефтепродукты оказывают вредное воздействие на окружающую среду. Например, аварии нефтяных судов стали настоящим бичом Мирового океана, нефтеперерабатывающие заводы являются источниками выбросов многочисленных вредных веществ.
Ежегодно в океан попадают более 10 млн. тонн нефти. Поверхность Мирового океана загрязняется танкерами, имеет место утечка нефти при подводном бурении. Например, в 1981 году в порту Клайпеда потерпел аварию танкер “Глобе Асими”, в море вылилось 1600 тонн мазута.
Нефтяные пленки на поверхности морей и океанов могут нарушать обмен энергией, теплом, влагой и газами между океаном и атмосферой. В конечном итоге они влияют на климат Земли, на баланс кислорода в атмосфере. Даже осевшие на дно нефтепродукты долгое время вредят всему живому.
В 1973 году было принято мировое соглашение по мерам безопасности танкерных перевозок, а также по ограничению выбросов от судовых двигателей.
Раньше танкеры мыли просто горячей водой, которую просто сливали за борт вместе с отмытой нефтью. Но ученые создали препараты для мойки танкеров, которые выполняют двойную задачу. Прежде всего, они значительно ускоряют мойку. Затем нефть самопроизвольно отделяется от моющего раствора, который можно использовать снова и снова, а собранную нефть можно утилизировать.
Наиболее часто применяемые способы борьбы с пролитой нефтью:
1. Самоликвидация.
2. Химическое рассеивание.
3. Метод осаждения.
4. Поглощение
5. Ограждение.
Все эти способы не идеальны. Поэтому самый верный способ борьбы с загрязнениями – не допускать аварий.
Домашнее задание: §§ 19-20 (Учебное пособие «Химия-11» А.П. Ельницкий, Е.И. Шарапа).
Тема 11. Спирты и фенолы
Лекция 23 Спирты
| 1.Спирты – _________________________________________________________________________ | |
| 2. Гомологический ряд одноатомных насыщенных спиртов. | Общая формула СnН2n+1ОН отражает __________________ ____________ , общая формула СnН2n+2О отражает______ _______________ одноатомных насыщенных спиртов. |
| 3.Насыщенные одноатомные спирты – _________________________________________________ ____________________________________________________________________________________ | |
| * Представители: | _______ СН4О; СН3ОН; 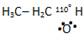
|
______ С2Н6О; С2Н5ОН; 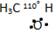
|
| 4. Изомерия –структурная - _______________________ | СН3- СН2- СН2- СН2 -ОН СН3- СН- СН2 -ОН ï СН3 |
| - ______________________ _______________________ | СН3- СН2- СН2- СН2 -ОН СН3- СН- СН2 - СН3 ï ОН |
| 5. Номенклатура: - ИЮПАК ~ неразветвленная углеродная цепь: нумерация с того конца, к которому ближе гидроксильная группа; к названию соответствующего алкана прибавляется суффикс -ол; начиная с пропанола, через дефис указывается номер атома углерода, к которому присоединена гидроксильная группа; разветвленная углеродная цепь: выбрать самую длинную цепь, содержащую гидроксильную группу; нумерация с того конца, к которому ближе гидроксильная группа; указать номера атомов углерода, у которых находятся заместители, заместители записать в алфавитном порядке, число одинаковых заместителей указать при помощи приставки; называние длинной цепи образуется от названия соответствующего алкана с прибавлением суффикса – ол; через дефис указывается номер атома углерода, к которому присоединена гидроксильная группа. | 4 3 2 1 СН3- СН2- СН2- СН2 -ОН ______________ 1 2 3 4 СН3- СН- СН2 - СН3 _____________________ ï ОН |
| 3 2 1 СН3- СН- СН2 -ОН _______________________ ï СН3 | |
| -тривиальные названия спиртов (образованы от названий алкильных групп) | СН3ОН метиловый спирт, СН3- СН2ОН _______ ___ спирт, СН3- СН2- СН2 - ОН _____________ спирт, СН3- СН2- СН2- СН2 -ОН __________ спирт, СН3- СН2- СН2- СН2 - СН2 -ОН __________ спирт. |
| 6. Физические свойства | |
| – агрегатное состояние при обычных условиях: | С_ – С__ жидкости, начиная с С__ твердые вещества; |
| – запах: | С_ – С_ характерный алкогольный; С_ – С_ сильный и часто неприятный; начиная с С__ практически отсутствует |
| – растворимость в воде: | С_– С_ смешиваются с водой в любых соотношениях; С_ – С_ – ограниченноÞ__________________________________________________ |
| Спирты обладают аномально высокими tкип по сравнению с алканами с приблизительно такой же Мr (tкип этанола 78°С, пропана - – 42°С). Причина: межмолекулярные водородные связи между положительно поляризованным атомом водорода гидроксильной группы одной молекулы и отрицательно поляризованным атомом кислорода другой молекулы спирта. Это приводит к значительной ассоциации молекул спиртовÞк росту теплоты испарения и tкип. Образованием водородной связи между молекулами спиртов и воды объясняется хорошая растворимость низших спиртов в воде. С увеличением длины алкильных групп влияние гидроксильной группы на свойства молекулы становится менее значимым, а увеличивается влияние алкильной группы. |
| 7. Химические свойства | с 1-атомными насыщенными спиртами взаимодействуют |
| - щелочные металлы с образованием алкоголятов | СН3- СН2-ОН + Na ® |
| - кислоты с образованием сложных эфиров ( реакция этерификации) | СН3СООН + СН3- СН2-ОН 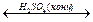
|
| СН3- СН2-ОН+ HOSO3H« | |
| - галогеноводороды с образованием соответствующих галогеналканов | СН3- СН2-ОН + HBr« |
| - реакция дегидратации (внутримолекулярной) с образованием алкенов | СН3- СН2-ОН 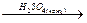
|
| - реакции окисления: * полного | С2Н5ОН+3О2® (выделяется большое количество теплоты) |
| * неполного с образованием альдегидов и карбоновых кислот | СН3- СН2-ОН + CuО 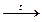
|
СН3- СН2-ОН 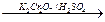
|
| 8. Физиологическое воздействие спиртов на организм | * метанол – ________________________________________________ _________________________________________________________ * этанол __________________________________________________ ________________________________________________________ _________________________________________________________ ________________________________________________________ ________________________________________________________ |
| 9. Многоатомные спирты | – спирты, ____________________________________________________ ____________________________________________________________ |
| Представители многоатомных спиртов, их состав, строение и структурные формулы. | |
| - этиленгликоль | - ______________ спирт СН2 – ОН ï СН2 – ОН |
| - глицерин | - ____________________ спирт СН2 – ОН ï СН– ОН ï СН2 – ОН пропантриол-1,2,3 |
Домашнее задание: §§ 21-23,26 (Учебное пособие «Химия-11» А.П. Ельницкий, Е.И. Шарапа).
1. Дайте названия производным спиртов по систематической номенклатуре:
сн3 сн3
│ │
Сн3—сн—сн—с—сн2—сн2—снCl—сн3
│ │
он сн3
OH Cl CH3
│ │ │
CH3—CHBr—CH—C—C—CH3
2. Стр.107, задача № 5.
Тема 11. Спирты и фенолы
Лекция 24. Фенол
Основные вопросы:
1. Понятие о фенолах.
2. Фенол:
a. состав, строение, молекулярная и структурная формулы.
b. Физические свойства фенола.
1. Фенолы – производные ароматических УВ, в молекулах которых один или несколько атомов водорода, непосредственно связанных с бензольным кольцом, замещены на гидроксильные группы. Число гидроксильных групп определяет атомность фенолов. Различают одно-, двух-, трехатомные фенолы в зависимости от количества гидроксильных групп.
 ОН ОН
|
ОН
 ОН
ОН
 | |||
 | |||

 ОН
ОН
ОН
 ОН
ОН
 |

ОН


 НО ОН
НО ОН
 | |||
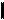 |
ОН

 ОН
ОН
 | |||
 | |||
НО
2. а. Простейшим представителем одноатомных фенолов является фенол (или моногидроксибензол, или гидроксибензол). Химическая формула фенолов: C6H5OH. Строение: группу атомов C6H5 – называют _________ группой. ОН – _____________ группа, функциональная группа ____________ и ____________.
ОН
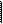


Выше изображены структурные формулы.
б. Физические свойства фенола:
* ___________________________________________________________________________________ _________________________________________________________________________________;
* ____________________________ (______________________________);
* _________________________________________________________________________________ _________________________________________________________________________________;
* __________________________________________________________________________________;
* __________________________________________________________________________________, __________________________________________________________________________________ __________________________________________________________________________________ __________________________________________________________________________________ __________________________________________________________________________________.
Домашнее задание: §§ 25, 27 (Учебное пособие «Химия-11» А.П. Ельницкий, Е.И. Шарапа).
Тема 12. Альдегиды и карбоновые кислоты
Лекция 25. Альдегиды
Основные вопросы:
1. Функциональная карбонильная группа; функциональная альдегидная группа, ее пространственное строение.
2. Гомологический ряд альдегидов. Общая формула насыщенных альдегидов.
3. Метаналь и этаналь как представители альдегидов, их состав, строение, молекулярные, структурные и электронные формулы.
4. Номенклатура ИЮПАК и тривиальные названия альдегидов.
5. Физические свойства альдегидов.
6. Химические свойства: реакция восстановления (водородом до спиртов) и окисления до карбоновых кислот.
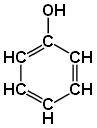
1. Альдегиды - органические вещества, молекулы которых содержат карбонильную группу 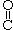 —, связанную с атомом водорода и углеводородным радикалом.
—, связанную с атомом водорода и углеводородным радикалом.
Общая формула альдегидов 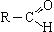 или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой.
или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой.
В карбонильной группе связь между атомами углерода и кислорода двойная. Атом углерода образует 3 σ-связи (одна из них – связь С–О), которые располагаются в одной плоскости под углом около 120° друг к другу.
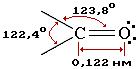
π-Связь образована р-электронами атомов углерода и кислорода.
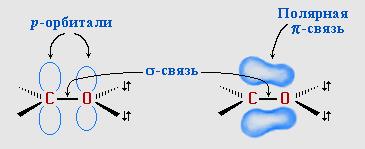
Связь С=О сильно полярна.
Электроны кратной связи С=О, в особенности более подвижные π-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд.

Полярность связи С=О влияет на физические и химические свойства альдегидов, которые являются высоко реакционноспособными веществами.
Дата добавления: 2015-08-14; просмотров: 1142;