ВИЧ-ИНФЕКЦИЯ
• ВИЧ-инфекция— это длительно текущее инфекционное заболевание, вызываемое вирусом иммунодефицита человека (ВИЧ), имеющее полиморфную клиническую картину с развитием в финале синдрома приобретенного иммунодефицита (СПИД) с тотальным угнетением иммунной системы, сопровождающимся развитием оппортунистических инфекций и опухолей (саркома Капоши, лимфомы). Заболевание всегда заканчивается летально.
Эпидемиология. Ведущие специалисты мира определяют ВИЧ-инфекцию как глобальную эпидемию — пандемию, масштабы которой пока еще трудно оценить.
ВИЧ-инфекция — новое заболевание. Первые случаи его стали появляться в США с 1979 г.: это были молодые гомосексуали-
сты с диагнозом пневмоцистной пневмонии и саркомы Капоши. Массовое возникновение данных оппортунистических болезней у молодых здоровых людей заставило предположить возможность нового заболевания, основным проявлением которого является состояние иммунодефицита. В 1981 г. официально заболевание было зарегистрировано как СПИД — синдром приобретенного иммунодефицита. В. дальнейшем оно было переименовано в ВИЧ-инфекцию, а название "СПИД" оставлено только за финальной стадией болезни. В последующие годы распространение ВИЧ-инфекции получило характер пандемии, которая, несмотря на все усилия медиков и правительств, продолжает развиваться, охватывая все новые и новые страны. К 1991 г. ВИЧ-инфекция зарегистрирована во всех странах мира, кроме Албании. По данным ВОЗ, к началу 1992 г. во всем мире было инфицировано 12,9 млн человек, из них 4,7 млн женщин и 1,1 млн детей. Одна пятая часть этих инфицированных людей (2,6 млн) имели к началу 1992 г. СПИД (последняя стадия болезни). Более 90 % из этих заболевших уже умерли. Большая часть больных выявлена в США, странах Западной Европы, Африке. В самой развитой стране мира — США уже в настоящее время инфицирован один из каждых 100—200 человек. Катастрофическое положение создалось в Центральной Африке, где в отдельных районах инфицировано 5—20 % взрослого населения. Примерно через каждые 8—10 мес число больных удваивается, из них половина умирают в течение 5 лет. По данным ВОЗ, к 2000 г. общее количество инфицированных составит 30—40 млн человек.
Среди заболевших преобладают лица в возрасте 20—50 лет (пик заболевания приходится на возраст 30—40 лет). Нередко болеют дети.
Источником зараженияявляются больной человек и вирусо-носитель. Наибольшая концентрация вируса обнаруживается в крови, сперме, цереброспинальной жидкости, в меньших количествах вирус обнаруживается в слезах, слюне, цервикальном и вагинальном секретах больных. В настоящее время доказаны три пути передачи вируса:
- половой (при гомосексуальных и гетеросексуальных контактах);
- посредством парентерального введения вируса с препаратами крови или инфицированными инструментами; - от матери ребенку (трансплацентарный, с молоком).
Другие теоретически допустимые пути, такие как воздушно-капельный, контактно-бытовой, фекально-оральный, трансмиссивный (через укус кровососущих насекомых), убедительных доказательств не получили. Так, из 420 000 обследованных, имевших бытовой контакт с ВИЧ-инфицированными людьми, за 6 лет выявлен один зараженный, который, как оказалось, имел половой контакт с вирусоносителем.
Группы риска ВИЧ-инфекции.Среди населения США, Канады, а также европейских стран четко определяются контингенты населения, в которых заболеваемость ВИЧ-инфекцией особенно велика. Это так называемые группы риска: 1) гомосексуалисты; 2) наркоманы, пользующиеся внутривенным введением наркотиков; 3) больные гемофилией; 4) реципиенты крови; 5) гетеросексуальные партнеры больных ВИЧ-инфекцией и вирусоносите-лей, а также входящих в группы риска; 5) дети, родители которых принадлежат к одной из групп риска.
Для пандемии ВИЧ-инфекции первой декады (80-е годы) была характерна неравномерность географического, расового и полового распределения случаев заболевания. В глобальном масштабе были выделены 3 модели (варианта). В США и других про-мышленно развитых странах с большим числом заболевших основными путями распространения вируса были гомосексуализм ивнутривенное применение наркотиков, причем среди больных примерно в 10—15 раз было больше мужчин. В Центральной, Восточной и Южной Африке, а также некоторых странах бассейна Карибского моря ВИЧ-инфекция распространялась преимущественно гетеросексуальным путем, при этом соотношение заболевших мужчин и женщин было равно единице. В этих районах была высока роль перинатальной (от матери ребенку) передачи вируса (15—22 % среди зараженных составляли дети; в США — только 1—4 %), а также заражение с донорской кровью. В Восточной Европе, на Ближнем Востоке, в Азии отмечались лишь единичные случаи заражения при половых контактах и внутривенных инъекциях, в некоторых случаях заболевание было вызвано импортированной донорской кровью икровепродук-тами.
В 1991 г. началась вторая декада пандемии ВИЧ-инфекции, по прогнозам, более тяжелая, чем первая. В ВОЗ накопился материал, свидетельствующий о том, что ВИЧ-инфекция во всех странах вышла за пределы перечисленных выше групп риска. В 1991 г. более 80 % новых случаев заражения во всем мире отмечается в основной популяции населения. При этом отмечается изменение структуры поражаемых контингентов в сторону увеличения абсолютного и относительного числа зараженных ВИЧ женщин и детей. Пандемия продолжает развиваться, распространяясь на все новые территории. Индия и Таиланд, в которых еще в середине 80-х годов не было случаев ВИЧ-инфекции, к началу 90-х годов превратились в один из наиболее пораженных районов. Тем не менее Россия пока еще мало затронута ВИЧ-инфекцией. К концу 1995 г. зарегистрировано 1100 ВИЧ-инфицированных, из них только у 180 диагностирован СПИД, в то время как в США число больных СПИДом превысило 500 000.
Распространению ВИЧ-инфекции в России препятствовали
два обстоятельства: политическая изоляция страны в 70—80-е годы (что в значительной мере ограничивало половые контакты с иностранцами, являющиеся одной из главных причин проникновения ВИЧ на новые территории) и ряд своевременных мероприятий, проведенных противоэпидемической службой страны. С 1987 г. введено обязательное тестирование доноров: случаев заражения при переливании крови с этого времени не отмечалось. В России с 1987 г., раньше, чем в других странах, была введена регистрация всех инфицированных ВИЧ, а не только больных СПИДом, что сыграло роль в своевременной организации противоэпидемических мероприятий. В России осуществляется массовое обследование населения на антитела к ВИЧ, охватывающее до 24 000 000 человек в год. При выявлении зараженных проводится обязательное эпидемиологическое расследование, позволяющее обнаружить как причины заражения, так и других зараженных. Особенно большую роль эти меры сыграли при обнаружении и локализации внутрибольничных вспышек ВИЧ-инфекции среди детей в Элисте, Ростове-на-Дону, в Волгограде в 1989—1990 гг. Уже несколько лет внутрибольничного распространения ВИЧ в стране не отмечается.
Таким образом, пока развитие эпидемии в России идет замедленными темпами. Однако ситуация по ВИЧ-инфекции в целом продолжает ухудшаться. Этому способствует, во-первых, все увеличивающиеся в последние годы контакты с зарубежными странами, что неизбежно увеличит завоз ВИЧ в страну, и, во-вторых, происходящая в России "сексуальная революция", не сопровождающаяся повышением сексуальной культуры населения. Неизбежно проникновение ВИЧ в среду наркоманов, проституток, число которых растет. Статистические данные свидетельствуют, что эпидемия среди мужчин-гомосексуалистов уже началась. Не прекратится и гетеросексуальная передача ВИЧ. Современная эпидемиологическая ситуация в России не позволяет строить оптимистический прогноз на будущее.
Этиология.Вирус заболевания впервые выделили в 1983 г. независимо друг от друга Р.Галло (США) и Л.Монтанье (Франция). Им оказался вирус из семейства Т-лимфотропных ретрови-русов, которому в 1986 г. было присвоено название ВИЧ. В последнее время его стали обозначать ВИЧ-1, поскольку обнаружен второй вирус (вирус "африканского СПИДа") — ВИЧ-2, который часто обнаруживается у коренных жителей Западной Африки. Кроме того, обнаружено огромное количество различных штаммов вируса благодаря его феноменальной склонности к му тациям.
Доказано, что в каждом первом геноме ВИЧ при каждой репликации есть хотя бы одна генетическая ошибка, т.е. ни один
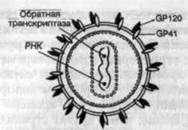
Рис. 8. Строение вируса иммунодефицита человека (схема).
дочерний вирион не воспроизводит родительский клон в точности. ВИЧ существует не иначе как только в качестве множества квази-видов.
Происхождение вируса спорно. Наиболее популярной является теория африканского происхождения, согласно которой ВИЧ уже в течение длительного времени существовал в Центральной Африке, где ВИЧ-инфекция носила характер эндемического заболевания. В середине 70-х годов в связи с усиленной миграцией населения из Центральной Африки, обусловленной засухой и голодом, ВИЧ был завезен в США и Западную Европе, где он долго циркулировал в среде гомосексуалистов, а далее стал распространяться на другие слои населения.
Диаметр зрелых вирусных частиц составляет 100—120 нм (рис.8). Нуклеоид содержит 2 молекулы РНК (геном вируса) и обратную транскриптазу. Капсид содержит 2 вирусных гликопроте-ида (оболочечные белки) — gp41 и gp 120, которые связаны между собой нековалентной связью и формируют отростки на поверхности вириона. Связь gpl20 и gp41 лабильна. Значительное количество молекул gpl20 (до 50 % синтезируемых клеткой) отрывается от вирусных частиц и попадает в кровь, что вносит существенный вклад в патогенез ВИЧ-инфекции (см. далее). Обо-лочечный белок gpl20 обеспечивает специфическое связывание вируса с клетками, несущими на своей поверхности антиген CD4.
ВИЧ нестоек во внешней среде и гибнет при температуре 56 °С в течение 30 мин, при 70—80 °С через 10 мин, быстро ин-активируется этиловым спиртом, ацетоном, эфиром, 1 % раствором глютаральдегида и др., но относительно устойчив к действию ионизирующей радиации и ультрафиолетовому облучению.
Биологические свойства ВИЧ-2 принципиально подобны свойствам ВИЧ-1, но есть и различия. Например, прочность связывания с рецептором CD4 у оболочечного белка ВИЧ-1 gpl20 на порядок выше, чем у гомологичного белка оболочки ВИЧ-2. Заболевание у людей, инфицированных ВИЧ-2, имеет замедленную динамику, т.е. протекает более медленно.
Патогенез. При заражении ВИЧ попадает в кровь (либо непосредственно при инъекциях, либо через поврежденные слизистые оболочки половых путей) и связывается с клетками, к которым он обладает тропизмом, т.е. несущими на своей мембране антиген CD4, — это прежде всего Т4-лимфоциты (хелперы), моноциты, макрофаги, дендритные клетки, внутриэпидермальные макрофаги (клетки Лангерганса), микроглия, нейроны. Обнаруженная недавно способность вируса инфицировать тимоциты, эо-зинофилы, мегакариоциты, В-лимфоциты, клетки трофобласта плаценты, сперматозоиды объясняется также наличием на поверхности этих клеток СD4-рецепторов. Кроме того, ВИЧ способен инфицировать клетки, не имеющие рецептора CD4 (особенно это относится к ВИЧ-2): клетки астроглии, олигодендроглии, эндотелий сосудов, кишечный эпителий и др. По-видимому, приведенный список инфицируемых клеток неполный. Но уже и так ясно, что ВИЧ-инфекцию нельзя считать локализованной в иммунной системе человека, как казалось вначале после первых работ по выделению вируса и по установлению его тропизма к субпопуляции Т4-лимфоцитов-хелперов. ВИЧ является генерализованной инфекцией с вовлечением большей части клеток организма. Возможно, что столь широким тропизмом к различным клеточным популяциям вирус обладает не изначально при инфицировании, а приобретает его в организме постепенно, благодаря своей феноменальной изменчивости. Следует отметить также способность ВИЧ рекомбинировать с другими вирусами с образованием псевдовирионов, в том числе несущих геном ВИЧ, заключенный в оболочку другого вируса. Это дает возможность ВИЧ инфицировать "чужие" клетки-мишени, которые специфичны для оболочки другого вируса.
При взаимодействии вируса с клеткой-мишенью его оболочка сливается с клеточной мембраной и содержимое вирусной частицы, включая генетический материал, оказывается внутри клетки (пенетрация). Далее происходит высвобождение нуклео-ида и геномной РНК вируса. С РНК вируса при помощи обратной транскриптазы снимается ДНК-копия, называемая провирусом, которая встраивается в хромосомную ДНК клетки-мишени (интеграция генома вируса в геном клетки). Вирусный генетический материал остается в клетке пожизненно, а при делении клетки передается потомству.
ВИЧ ведет себя по-разному в зависимости от типа зараженной клетки, уровня ее активности, а также состояния иммунной системы.
В Т4-хелперах он может находиться в латентном состоянии неопределенно долго, скрытый от иммунной системы организма (этим объясняется возможность длительного латентного вирусоносительства при ВИЧ-инфекции). Латентная стадия инфекции — это период, в течение которого ДНК провируса интег-
рироваиа в геном, но транскрипции и трансляции с геном вируса нет. Соответственно нет и экспрессии антигенов вируса. Следовательно, иммунологическими методами эта стадия инфекции не распознается. Активация Т4-лимфоцитов, например, при инфицировании другим агентом может спровоцировать бурную репликацию вируса, в результате которой образуется множество вири-онов, отпочковывающихся от клеточной мембраны: при этом происходит массовая гибель клеток — цитопатический эффект вируса (рис.9).
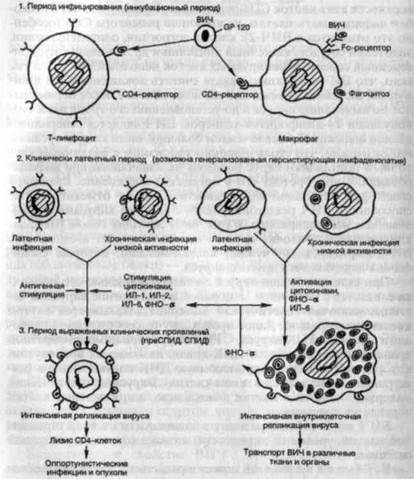
Рис. 9. Взаимодействие ВИЧ и основных клеток-мишеней — Т-лимфоцитов (хелперов) и макрофагов — в различные стадии ВИЧ-инфекции (схема) [Robins IS., Cotran R.S., 1995].
В моноцитах и макрофагах репликация происходит постоянно, но очень медленно, вирионы формируются в цитоплазме (используются обычно элементы мембран ультраструктур), не оказывая выраженного цитопатического действия, но изменяя функциональное состояние клетки. Этот тип клеток выполняет роль "троянского коня", переносящего ВИЧ в различные ткани, и прежде всего — в ЦНС, где ВИЧ обнаруживается у 90 % инфицированных, причем в ранние сроки от начала инфекции. Как выяснилось, ВИЧ непосредственно (при отсутствии оппортунистических инфекций и новообразований) приводит к гибели 33—30 % нейронов.
Разнообразное поведение вируса в различных клетках определяется сложной организацией его генома, в состав которого входят не только структурные гены (определяющие синтез ви-русспецифических белков), но и регуляторные гены (обнаружено 7 регуляторных генов), взаимодействие которых определяет начало и интенсивность репликации вируса. Сложные механизмы регуляции репликации вируса на уровне генома самого ВИЧ находятся в тесном взаимодействии с регуляторными механизмами на уровне клетки-носителя и на уровне организма.
В процессе эволюции ВИЧ приобрел способность использовать для своей активации механизмы активации иммунных клеток. Так, экспрессия вируса в Т-лимфоцитах вызывается следующими факторами: 1) специфической антигенной стимуляцией (при попадании какого-либо антигена в организм активация ВИЧ происходит прежде всего в антигенспецифичных клонах Т-лим-фоцитов); 2) митогенами Т-лимфоцитов; 3) цитокинами (ИЛ-1; ИД-2; ИЛ-6; ФНО-а и др.); 4) одновременной инфекцией другими вирусами (цитомегаловирусом, вирусами герпеса, аденовирусами и др.).
В моноцитах латентная инфекция ВИЧ может быть активирована такими факторами, как ФНО, ИЛ-6, а также бактериальными иммуностимуляторами (микобактериальными, сальмонел-лезными и др.). Таким образом, сопутствующие инфекции, вызванные другими вирусами и бактериями, могут быть сильнодействующими кофакторами в клинической манифестации и про-грессировании ВИЧ-инфекции. Напротив, интерферон-а подавляет продукцию ВИЧ, повреждая процессы отпочковывания дочерних вирионов от клеток-носителей. Имеются данные, что на уровне организма репродукция вируса регулируется кортикосте-роидными гормонами: показано, что дексаметазон и гидрокортизон действуют синергично с ФНО-а и ИЛ-6, повышая биосинтез вирусных белков и усиливая репродукцию вируса. Повышение температуры тела свыше 40 °С приводит к усилению репродукции ВИЧ в отличие от многих других вирусов.
Хотя ВИЧ-инфекция многолика, первичным, основным и постоянным проявлением ее является нарастающий иммунодефицит, который объясняется вовлечением в процесс всех звеньев иммунной системы. Ведущим звеном в развитии иммунодефицита считают поражение Т4-лимфоцитов (хелперов), которое подтверждается у больных ВИЧ-инфекцией прогрессирующей лимфопенией (в основном за счет Т-хелперов) и снижением соотношения Т4/Т8 (хелперно-супрессорного), которое у больных всегда меньше 1. Снижение хелперно-супрессорного индекса является одной из главных особенностей иммунологического дефекта у больных ВИЧ-инфекцией и определяется при всех ее клинических вариантах.
Механизм лимфопении нельзя сводить только к цитопа-тическому действию вируса, проявляющемуся при его интенсивной репликации, поскольку только одна из 1000 клеток содержит вирус. Большое значение имеет образование нежизнеспособных многоядерных симпластов при взаимодействии оболочечного gpl20 вируса, обычно экс-прессируемого на поверхности зараженной клетки с CD4-penen-торами на нормальных Т4-клетках. Причем одна зараженная клетка может связать до 500 нормальных. Часто экспрессируе-мые на поверхности инфицированных клеток вирусные антигены стимулируют иммунный ответ в виде продукции анти-ВИЧ-антител и цитотоксических лимфоцитов, которые обусловливают цитолиз поврежденных клеток. Под удар иммунной системы попадают и непораженные Т4-клетки, которые в ряде случаев связывают свободные молекулы вирусного gpl20.
Установлено, что ВИЧ приводит не только к лимфопении, но и к потере сохранившимися клетками способности осуществлять узнавание антигена — решающую стадию иммунного ответа. Основным механизмом, ответственным за это, также является связывание свободно циркулирующего капсидного белка gpl20 с СD4-рецепторами нормальных Т4-лимфоцитов, что является для клетки "отрицательным сигналом", приводящим к быстрой и существенной элиминации молекул CD4 с поверхности клетки. Как известно, функция молекулы CD4 заключается в обеспечении взаимодействия рецептора Т-лимфоцита для антигена с антигенами II класса главного комплекса гистосовместимости 2-ГКГС на антигенпредставляющих клетках. В результате исчезновения СD4-рецепторов клетка утрачивает способность к нормальному взаимодействию с молекулой 2-ГКГС и рецептором для антигена, т.е. к нормальному иммунному ответу. Таким образом не только цельные вирусы ВИЧ, непосредственно инфицирующие Т-лимфоциты-хелперы, но и отдельный растворимый белок gpl20 вызывают сильную иммуносупрессию путем инактивации
нормальной функции молекулы CD4. Особенно сильный имму-носупрессорный эффект оказывает агрегированный специфическими антителами gp 120. Кроме того, по-видимому, аналогичным иммуносупрессорным механизмом обладает и вирусный белок р67. В развитии иммуносупрессии при ВИЧ-инфекции играют роль и аутоиммунные механизмы, обусловленные перекрестной реактивностью собственных антигенов клеток и вирусных антигенов. Так, обнаружены противовирусные антитела, способные реагировать с антигенами 2-ГКГС и способные эффективно угнетать функцию антигенпредставляющих клеток, а следовательно, и иммунный ответ
Количественные и качественные изменения Т4-лимфоцитов (хелперов), которые являются "дирижерами" иммунного процесса, а также повреждение вирусом макрофагов приводят к грубому полому как клеточного (в первую очередь), так и гуморального иммунитета. Изменения клеточного иммунитета у больных ВИЧ-инфекцией подтверждаются резким снижением (до полной утраты в финале заболевания) реакций ГЗТ на различные антигены, а также снижением реакции бласттрансформации in vitro. Нарушения гуморального иммунитета проявляются неспецифической поликлональной активацией В-клеток, сопровождающейся повышением уровня сывороточных иммуноглобулинов. Эта реакция объясняется непрерывной и массированной стимуляцией В-лимфоцитов вирусными антигенами, а также выбросом из поврежденных Т-лимфоцитов и макрофагов гуморальных факторов, стимулирующих В-лимфоцитарную систему—ФНО, ИЛ-1, ИЛ-6, ИЛ-2 и др. При этом способность к специфическому гуморальному ответу снижается ВО мере прогрессирования заболевания. Предполагают, что гиперстимуляция В-системы в условиях Т-иммунодефицита является причиной появления злокачественных лимфом при ВИЧ-инфекции. В финале заболевания развивается угнетение и гуморального звена иммунитета.
Особенности взаимодействия ВИЧ с клеткой, а также раннее и прогрессирующее повреждение иммунной системы приводят ктому, что организм оказывается неспособным как элиминировать сам ВИЧ, так и противостоять вторичной инфекции. Особенно страдает защита от вирусов, грибов, некоторых бактерий (в частности, микобактерий туберкулеза), которая осуществляется в основном клеточными механизмами. Страдает также и противоопухолевый иммунитет. Ведущими в клинической картине ВИЧ-инфекции становятся оппортунистические инфекции и опухоли.
Патогенез ВИЧ-инфекции.В настоящее время полагают, что у всех инфицированных ВИЧ рано или поздно возникнет заболевание. ВИЧ-инфекция развивается в течение длительного срока (от 1 до 15 лет), медленно прогрессирует, проходя несколько пе-
 риодов (стадий), имеющих определенное клиническое и морфологическое выражение.
риодов (стадий), имеющих определенное клиническое и морфологическое выражение.
1. Инкубационный период. По-видимому, этот период зависит от путей и характера заражения, величины инфицирующей дозы, а также от первоначального состояния иммунной системы и может длиться от нескольких недель до 10—15 лет (в среднем — 28 нед). В этот период можно установить сам факт инфицирования путем определения в крови антигена или несколько позднее (с 6—8-й недели заболевания) — анти-ВИЧ-антитела Период появления анти-ВИЧ-антител получил название серокон-версии. Количество вирусных антигенов в крови в первое время резко увеличивается, но затем по мере развития иммунного ответа начинает уменьшаться вплоть до полного исчезновения (3— 17 нед). В период сероконверсии может отмечаться синдром получивший название острой ВИЧ-инфекции (у 53— 93 % больных), который проявляется симптомами различной степени тяжести: от увеличения только периферических лимфатических узлов до развития гриппоподобного или мононуклеозопо-добного заболевания. Наиболее часто встречающимися симптомами при острой ВИЧ-инфекции являются лихорадка, слабость головная боль, боли в горле, миалгии, артралгии, лимфаденопа тия и пятнисто-папулезная сыпь. Длительность острого периода инфекции, как правило, варьирует от 1—2 до 6 нед. Трудность ди агностики острого периода заболевания обусловлена отсутствием в большинстве случаев характерных для ВИЧ-инфекции клинических проявлений иммунодефицита.
2. Персистирующая генерализованная л и м-фаденопатия. Характеризуется стойким (больше 3 мес) увеличением различных групп лимфатических узлов. В основе ее лежит неспецифическая гиперреактивность В-клеток, проявляющаяся фолликулярной гиперплазией — увеличением лимфоид-ных фолликулов за счет резкого увеличения светлых центров Длительность стадии составляет 3—5 лет.
3. ПреСПИД, или СПИД-ассоциированный комплекс, возникает на фоне умеренного иммунодефицита Для него характерны лимфаденопатия, лихорадка, диарея потеря массы тела (обычно до 10 %). В этом периоде появляется склонность к развитию вторичных инфекций — ОРВИ, опоясывающего лишая, пиодермии и т.д. Эта стадия длится также несколько лет.
4. Синдром приобретенного иммунодефицита — С П И Д. Это четвертая стадия заболевания, которая характеризуется развитием развернутой картиной СПИДа с характерными для него оппортунистическими инфекциями и опухолями, который в среднем продолжается до 2 лет. В этом периоде, как правило, снижается количество анти-ВИЧ-антител
(в финале они вообще могут не определяться) и нарастает коли
чество вирусных антигенов. Это обстоятельство надо учитывать при диагностике заболевания в данной стадии.
Классификация. Течение ВИЧ-инфекции, длительность ста-дий и клинико-морфологические проявления чрезвычайно вари абельны, в связи с чем создано несколько классификаций (в ос-новном клинических) ВИЧ-инфекции. Наибольшее распростра нение получили классификации стадий заболевания по СDС (Center for Disease Control, Атланта) и по WR (Walter Reed — название места, в котором проходил симпозиум врачей, принявших эту классификацию).
Согласно классификации по CDC, выделены 4 стадии ВИЧ-инфекции:
I. Острый преходящий гриппомононуклеозоподобный синдром в ранние сроки после заражения (лихорадка, недомогание, лимфаденопатия, фарингит). Продолжительность 2—4 нед.
II. Клинически бессимптомная стадия. Продолжительность от 1 мес до 10 лет и более.
III. Генерализованная лимфаденопатия — единственный клинический синдром.
IV. Складывается из следующих проявлений: а) общее недомогание, продолжительная лихорадка, продолжительная диарея;
б) превалирует неврологическая симптоматика (нейро-СПИД);
в) 1 — тяжелые оппортунистические инфекции (пневмония
Pneumocystis carinii и подобные), 2 — оппортунистические инфек
ции средней тяжести (кандидоз полости рта, пищевода и пр.); г)
саркома Капоши; д) другие индикаторные, ассоциированные со
СПИД болезни (интерстициальная пневмония и пр.).
Классификация стадий ВИЧ-инфекции по WR включает в себя, кроме физикальных данных, три показателя лабораторных анализов, без которых трудно поставить точный диагноз (табл. 8): 1) наличие анти-ВИЧ-антител или вирусных антигенов; 2) концентрация Т4-лимфоцитов в крови; 3) кожный тест ГЗТ.
Таблица 8. Классификация стадий ВИЧ-инфекции по "WR"
| Симптомы | ||||||
| Стадия | Антитела | Т4/мкл | ГЗТ | лимфаде- | кандидоз- | оппорту- |
| и/или антигены ВИЧ | нопатия | ныи стоматит | нистические инфекции | |||
| WR 0 | _ | >400 | Норма | _ | ||
| WR 1 | + | >400 | » | - | ||
| WR 2 | + | >400 | » + | - | ||
| WR 3 | + | <400 | +/- | . | ||
| WR 4 | + | <400 | Снижена +/- | - | ||
| WR 5 | + | <400 | Нет +/- | +/- | ||
| WR 6 | + | <400 | +/- | +/- + |
К сожалению, ни одна из существующих ныне классификаций не удовлетворяет всем требованиям клиницистов. Это явилось причиной создания в нашей стране классификации [Покровский В.И., 1989], согласно которой в течении заболевания выделены 4 стадии:
1. Стадия инкубации.
2. Стадия первичных проявлений (острая инфекция, бессимптомная инфекция, генерализованная лимфаденопатия).
3. Стадия вторичных заболеваний:
А — потеря менее 10 % массы тела; грибковые, вирусные, бактериальные поражения кожи и слизистых оболочек; опоясывающий лишай, повторные фарингиты, синуситы;
Б — потеря более 10 % массы тела, необъяснимая диарея или лихорадка продолжительностью более 1 мес, волосистая лейкоплакия, туберкулез легких, повторные или стойкие вирусные, бактериальные, грибковые, протозойные поражения внутренних органов, повторный или диссеминированный опоясывающий лишай, локализованная саркома Капоши;
В — генерализованные бактериальные, вирусные, грибковые, протозойные и паразитарные заболевания, пневмоцистная пневмония, кандидоз пищевода, внелегочный туберкулез, атипичные микобактериозы, кахексия, диссеминированная саркома Капоши, поражения ЦНС различной этиологии.
4. Терминальная стадия.
Введение в классификацию стадии инкубации, включающей период от момента заражения до первых клинических проявлений и/или выработки антител дало возможность при использовании методик, позволяющих выявлять в зараженном организме вирус или его фрагменты, диагностировать заболевание и на этой стадии. Стадия первичных проявлений включает состояния, обусловленные непосредственно взаимодействием макроорганизма с ВИЧ. Присоединение на фоне иммунодефицита вторичных возбудителей и появление опухолей свидетельствует о переходе болезни в стадию вторичных заболеваний. Терминальная стадия может развиться не только в результате прогрессирова-ния состояний, характерных для стадии ЗВ, но и вследствие поражения ЦНС, вызванного другими, помимо ВИЧ, возбудителями. Таким образом, в данную классификацию вмещаются все проявления болезни от момента заражения до гибели больного. Среди взрослых больных ВИЧ-инфекцией 74 % имеют те или иные клинические проявления болезни, а 70 % — лабораторные признаки клеточного иммунодефицита. Больные с клиническими проявлениями, соответствующими определению СПИДа по критериям CDC, составляют лишь 5 %. Поскольку число больных СПИДом не отражает общего уровня заболеваемости и четкой клиниче-
ской грани между этими больными и остальными больными ВИЧ-инфекцией нет, то считают, что выделение их в отдельную группу нецелесообразно как с эпидемиологической, так и с клинической точки зрения.
Патологическая анатомия.Морфология ВИЧ-инфекции складывается из изменений лимфатических узлов, характерных поражений ЦНС (связанных с ВИЧ) и морфологии оппортунистических инфекций и опухолей. В стадии СПИДа фолликулярная гиперплазия лимфатических узлов сменяется истощением лимфоидной ткани. Лимфатические узлы резко уменьшаются, определяются с трудом. К специфическим проявлениям СПИДа относят В И Ч - э н-цефаломиелит с поражением преимущественно белого вещества и подкорковых узлов. Микроскопически характерно образование глиальных узелков, многоядерных симплатов (в которых удается обнаружить частицы ВИЧ при электронно-микроскопическом исследовании). Характерны очаги размягчения и вакуолизация белого вещества, особенно боковых и задних рогов спинного мозга. Благодаря демислинизации белое вещество приобретает серый оттенок.
Для оппортунистических инфекций при СПИДе характерны тяжелое рецидивирующее течение часто с генерализацией процесса и устойчивость к проводимой терапии. Оппортунистические инфекции могут вызываться простейшими (пневмо-цистами, токсоплазмами, криптоспоридиями); грибами (рода Candida, криптококками), вирусами (цитомегаловирусами, вирусами герпеса, некоторыми медленными вирусами); бактериями (Mycobacterium avium intracellulare, легионеллой, сальмонеллой).
Одна из самых характерных оппортунистических инфекций — пневмоцистная (Pneumocystis carinii) пневмония, являющаяся основной причиной смерти у 65—85 % больных ВИЧ-инфекцией в США и странах Европы. P.carinii — одноклеточный микроорганизм, который может существовать в стадии цисты или вегетативной форме, локализуется в просвете легочных альвеол. Пневмоцистоз у лиц с нарушениями клеточного иммунитета может развиваться вследствие предшествующего наличия пневмоцист в легочных очагах латентной инфекции либо в результате свежего инфицирования. В легочной ткани P.carinii способны к длительному персистированию, находясь в стадии цист. В случае активации возбудителя и усиленном его размножении происходят отек и десквамация клеток альвеолярного эпителия и заполнение альвеол пенистой жидкостью. При этом развивается гипоксия, а при быстром прогрессировании болезни возможно нарастание дыхательной недостаточности с развитием отека легких. Типична нарастающая одышка на фоне скудных физикаль-ных и рентгенологических данных. Характерно, что у ВИЧ-ин-
фицированных не отмечается выраженной стадийности ни в клинической, ни в морфологической картине, свойственной описанной ранее классической пневмоцистной пневмонии (ранняя — отечная, ателектатическая, эмфизематозная). У больных ВИЧ-инфекцией морфологические изменения часто отражают рецидивирующее течение болезни, однако всегда можно обнаружить характерные пенисто-ячеистые массы в альвеолах, где содержатся пневмоцисты, а также полнокровие и клеточную инфильтрацию межальвеолярных перегородок с возможной деструкцией их. Пневмоцистная пневмония может протекать в виде смешанной инфекции с присоединением другой микрофлоры (грибы, ци-томегаловирус, кокки, микобактерии и др.).
Токсоплазменная инфекция прежде всего поражает ЦНС: возникает токсоплазменный энцефалит (встречается в США у 28 % ВИЧ-инфицированных), для которого характерны фокусы некроза и абсцедирования. При криптоспоридиозе поражается кишечник, развиваются колиты и энтериты, проявляющиеся длительной профузной диареей. Среди поражений грибами часто отмечаются кандидоз с вовлечением пищевода, трахеи, бронхов, легких, а также криптококкоз, склонный к диссеминации процесса. Из вирусных инфекций наиболее типична цитомегалови-русная с развитием ретинита, эзофагита, гастрита, колита, пнев-монита, гепатита, энцефалита. Ретинит зарегистрирован у 5—20 % больных ВИЧ-инфекцией в США и характеризуется некротическим поражением сетчатки, которое быстро прогрессирует и в отсутствие лечения приводит к слепоте. Герпетической инфекции свойственно длительное поражение слизистых оболочек и кожи. Среди бактериальных инфекций наиболее типична мико-бактериальная инфекция, вызванная M.avium intracellulare, которая приводит к развитию диссеминированного процесса с поражением лимфатических узлов и внутренних органов.
Туберкулез у больных ВИЧ-инфекцией может возникнуть задолго до развития оппортунистических инфекций. У большинства ВИЧ-инфицированных туберкулезный процесс связан с реактивацией ранее приобретенной инфекции. Внелегочный туберкулез составляет половину всех случаев туберкулеза. У 10—12 % больных ВИЧ-инфекцией в США причиной поражения органов дыхания и желудочно-кишечного тракта являются микобактерии птичьего типа, однако их выделение из мокроты, мочи или фекалий не является достоверным свидетельством заболевания, так как возможно их носительство вследствие широкого распространения во внешней среде.
Злокачественные опухоли при ВИЧ-инфекции встречаются в 40 % случаев. Наиболее характерными являются саркома Капоши (у 30 % больных) и злокачественные лимфомы.
Саркома Капоши (множественная идиопатическая геморрагическая саркома) — редкое заболевание, возникающее обычно у мужчин старше 60 лет, характеризуется медленным довольно доброкачественным течением. Проявляется багровыми пятнами, бляшками, узлами, расположенными обычно на коже дисталь-ных отделов конечностей. Могут наблюдаться изъязвления. Возможна самопроизвольная инволюция с возникновением на месте опухоли рубцов и депигментированных пятен. Микроскопически опухоль состоит из множества новообразованных хаотично расположенных тонкостенных сосудов и пучков веретенообразных клеток. Часто видны кровоизлияния и скопления гемосидерина. У больных ВИЧ-инфекцией саркома Капоши имеет злокачественный характер и отличается от классического варианта генерализацией процесса с поражением лимфатических узлов, желудочно-кишечного тракта, легких и других внутренних органов.
Злокачественные лимфомы при ВИЧ-инфекции преимущественно В-клеточные. Часто встречается лимфома Беркитта. Нередко наблюдаются первичные лимфомы ЦНС, желудочно-кишечного тракта (особенно ректоанальной зоны).
Оппортунистические инфекции в злокачечтвенные опухоли
настолько типичны для ВИЧ-инфекции (особенно заключительной ее стадии), что получили название индикаторных болезней, или указателей ВИ Ч инфекции. Наличие этих заболеваний позволяет заподозрить и диагностировать ВИЧ-инфекцию. Список их постоянно уточняется. В 1993 г. ВОЗ пересмотрел критерии постановки диагноза СПИДа для взрослых больных ВИЧ-инфекцией. Согласно этим критериям (европейская версия 1993 г.), диагноз может быть поставлен взрослому больному при положительной реакции сыворотки с антигенами ВИЧ в иммунном блоттингс и при выявлении индикаторных заболеваний: кандидоза трахеи, бронхов и легких; кандидоза пищевода; рака шейки матки (инвазивного); кокцидиомикоза (диссеминированного или внелегочного); внелегочного криптокок-коза; хронического криптоспоридиоза (продолжительностью более 1 мес); цитомегаловирусной инфекции с поражением органов, кроме печени, селезенки, лимфатических узлов; цитомега-ловирусного ретинита (с потерей зрения); энцефалопатии, обусловленной ВИЧ; простого герпеса (хронические язвы продолжительностью более 1 мес или бронхит, пневмония, эзофагит); гистоплазмоза (диссеминированного или внелегочного); хронического изоспориаза кишечника (более 1 мес); саркомы Капоши; лимфомы Беркитта; иммунобластной лимфомы; первичной лимфомы ЦНС; микобактериозов, обусловленных М. Kansasii и М. avium (диссеминированных или внелегочных); пневмоцистной пневмонии; возвратных пневмоний; прогрессирующей многоочаговой лейкоэнцефалопатии; сальмонеллезных септицемии (воз-
вратных); токсоплазмоза мозга; синдрома истощения, обусловленного ВИЧ.
Диагноз СПИДа можно ставить без лабораторного подтверждения ВИЧ-инфекции, если диагностированы достоверными методами кандидоз пищевода, трахеи, бронхов или легких; внеле-гочный криптококкоз; криптоспоридиоз с диареей, длящейся более 1 мес; цитомегаловирусное поражение других органов (кроме печени, селезенки, лимфатических узлов) у больных старше 1 мес; инфекция вирусом простого герпеса, вызывающего множественные язвы, не заживающие более 1 мес, или бронхит, пневмонию или эзофагит; саркома Капоши у пациентов моложе 60 лет; лимфома ЦНС (первичная) у пациентов моложе 60 лет; инфекция, вызванная возбудителем группы Mycobacterium avium или M.Kansasii (диссеминированная, с локализацией поражений, помимо легких, кожи, шейных и ворот печени лимфатических узлов); пневмоцистная пневмония; прогрессивная многоочаговая лейкоэнцефалопатия, токсоплазмоз легких у пациентов старше 1 мес.
Частота разных оппортунистических инфекций существенно различается в зависимости от географических, социальных и других особенностей. В России среди оппортунистических инфекций зарегистрированы грибковые и герпетические поражения, пневмоцистная пневмония, туберкулез, токсоплазмоз. Широкое распространение на территории страны криптоспоридий и изоспор позволяет предположить, что в будущем эти возбудители могут стать причиной тяжелых диарей. Среди грибковых инфекций наиболее распространены кандидоз и криптококкоз. Гистоплаз-моз характерен для Центральной Африки и Юго-Востока США. В Африке на первом месте среди причин летальных исходов стоят оппортунистические инфекции с тяжелой диареей, вызванные паразитами семейства кокцидий — криптоспоридиями и изоспо-рами. Характерно течение оппортунистических инфекций в виде смешанных инфекций; наблюдается также смена одного возбудителя другим в процессе болезни.
Клинические варианты.Многообразие оппортунистических инфекций, часто сочетающихся между собой, а также с опухолями, делает клиническую картину ВИЧ-инфекции чрезвычайно разнообразной. В связи с этим выделяют несколько наиболее типичных клинических вариантов ВИЧ-инфекции: легочный, синдром поражения центральной нервной системы, желудочно-ки щечный синдром, лихорадку неясного генеза.
Легочный вариант — самый частый (у 80 % больных). Он представлен сочетанием пневмоцистной пневмонии, цитоме галовирусной и атипичной микобактериальной инфекции и cap комы Капоши.
Синдром поражения центральной нервной системы включает ВИЧ-энцефалит, поражения, связанные с токсоплазмозом, криптококкозом и цитомегаловирусной инфекцией, а также лимфому; приводит к развитию деменции.
Желудочно - кишечный синдром — это сочетание кандидоза, цитомегаловирусной инфекции, криптоспоридио-за и атипичной микобактериальной инфекции; сопровождается диареей и развитием в финале кахексии.
Лихорадка неясного генеза: в ряде случаев удается обнаружить атипичную микобактериальную инфекцию или злокачественную лимфому.
Причины смерти;Смерть наступает чаще от оппортунистических инфекций и/генерализации опухолей. В развитых странах 50 % больных умирают в течение 18 мес со дня постановки диагноза (СПИД) и 80 % — в течение 36 мес. Летальность при СПИДе достигает 100 %.
Дата добавления: 2015-08-14; просмотров: 1186;
