Термодинамические процессы идеальных газов в закрытых системах
1. изохорный - протекающий при постоянном объеме;
2. изобарный - протекающий при постоянном давлении;
3. изотермический - происходящий при постоянной температуре;
4. адиабатный - процесс, при котором отсутствует теплообмен с окружающей средой;
5. политропный - удовлетворяющий уравнению pvn = const.
Изохорный процесс.При изохорном процессе выполняется условие dv = 0 или v = const.
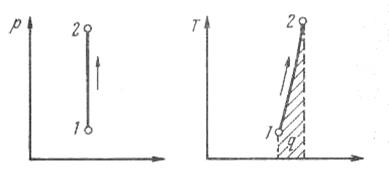
Рис. 1.13. Изображение изохорного процесса
в р, v - и Т, s-координатах
Давление газа прямо пропорционально его абсолютной температуре:
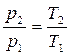 .
.
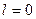 ;
; 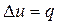 ;
; 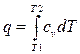 ;
;
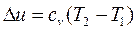 при
при 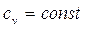 ;
; 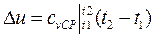 при
при 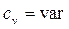 .
.
Изобарный процесс.При изобарном процессе выполняется условие p = const.
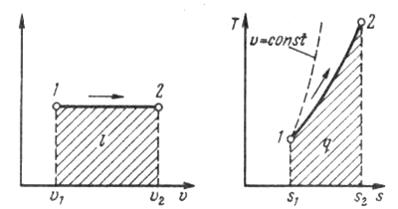
Рис. 1.14. Изображение изобарного процесса
в р, v - и Т, s-координатах
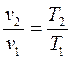 .
.
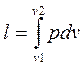 ;
; 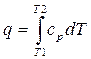 ;
;
Изотермический процесс.При изобарном процессе выполняется условие t = const.
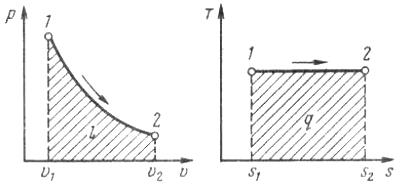
Рис. 1.15. Изображение изотермического процесса
в р, v - и Т, s-координатах
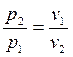 .
.
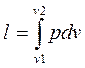 ;
; 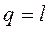 ;
; .
.
Адиабатный процесс. При адиабатном процессе выполняется условие  .
.
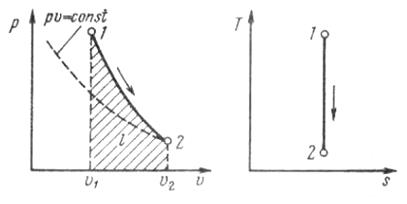
Рис. 1.16. Изображение адиабатного процесса
в р, v - и Т, s-координатах
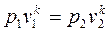 .
.
где -показатель адиабаты; k=1.66 – для одноатомного газа; k=1.4 – для двухатомного газа; k=1.33 – для многоатомного газа.
-показатель адиабаты; k=1.66 – для одноатомного газа; k=1.4 – для двухатомного газа; k=1.33 – для многоатомного газа.
Политропный процесс.Любой произвольный процесс можно описать в р, v -координатах (по крайней мере на небольшом участке) уравнением
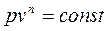 ,
,
подбирая соответствующее значение п. Процесс, описываемый данным уравнением называется политропным (всякий процесс идеального газа, в котором удельная теплоемкость является постоянной величиной, называется политропным). Показатель политропы п может принимать любое численное значение в пределах от – ¥ до + ¥, но для данного процесса он является величиной постоянной.
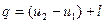 ;
;
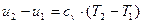 ;
;
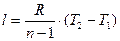 ;
;
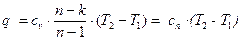 ,
,
где 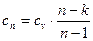 - теплоемкость идеального газа в политропном процессе.
- теплоемкость идеального газа в политропном процессе.
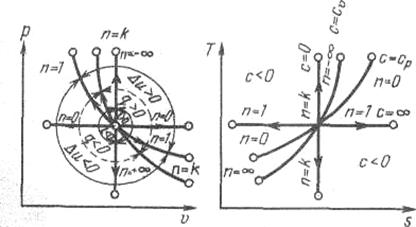
Рис. 1.17. Изображение основных термодинамических процессов идеального газа в р, v - и Т, s-координатах
Основные понятия и определения водяного пара
Парообразование – процесс превращения вещества из жидкого состояния в газообразное.
Испарение – парообразование, которое происходит всегда при любой температуре со свободной поверхности жидкости или твердого тела.
Кипение – процесс парообразования, как на свободной поверхности жидкости, так и внутри ее (наступает при некоторой температуре, зависящей от физических свойств рабочего тела и давления).
Конденсация – переход вещества из газообразного состояния в жидкое или твердое.
Конденсат – жидкость полученная при конденсации пара.
Сублимация – процесс перехода твердого вещества непосредственно в пар.
Насыщенным называется пар, находящийся в термическом и
динамическом равновесии с жидкостью, из которой он образуется.
Сухим насыщенным называется пар, в котором отсутствуют взвешенные частицы жидкой фазы. Его удельный объем и температура являются функциями давления. Поэтому состояние сухого пара можно задать любым из параметров – давлением, удельным объемом или температурой.
Влажным насыщенным паром называется двухфазная смесь, представляющая собой пар со взвешенными в нем капельками жидкости. Состояние влажного пара характеризуется двумя параметрами: давлением (или температурой насыщения ts, определяющей это давление) и степенью сухости пара.
Степень сухости (х) – массовая доля сухого насыщенного пара во влажном. Обратная величина степени сухости (1-х) – степень влажности.
Перегретый пар – это пар, температура которого превышает температуру насыщенного пара того же давления. Состояние перегретого пара, как и любого газа, определяется двумя любыми независимыми параметрами (пар является насыщенным; по своим физическим свойствам приближается к газу и тем ближе, чем выше степень перегрева).
p,v-диаграмма водяного пара
Рассмотрим процесс получения пара. Для этого 1 кг воды при температуре 0 0С поместим в цилиндр с подвижным поршнем. Приложим к поршню извне некоторую постоянную силу P. Тогда при площади поршня F давление будет постоянным и равным 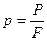 . Изобразим процесс парообразования (превращения вещества из жидкого состояния в газообразное) в p,v-диаграмме.
. Изобразим процесс парообразования (превращения вещества из жидкого состояния в газообразное) в p,v-диаграмме.
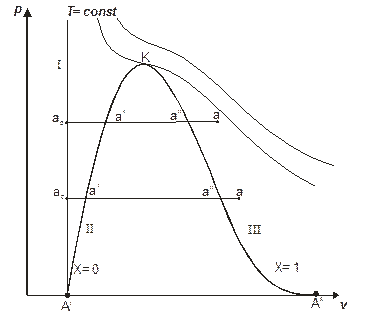
Рис. 1.18. p,v-диаграмма водяного пара
Начальное состояние воды, находящейся под давлением р и имеющей температуру 0 0С, изобразится на диаграмме точкой а0. При подводе теплоты к воде ее температура постепенно повышается до тех пор, пока не достигнет температуры кипения ts, соответствующей данному давлению. При этом удельный объем жидкости сначала уменьшается, достигает минимального значения при t=4 0С, а затем начинает возрастать (аномалия у воды). Состояние жидкости, доведенной до температуры кипения, изображается на диаграмме точке 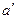 .
.
При дальнейшем подводе теплоты начинается кипение воды с сильным увеличением объема. В цилиндре теперь находится двухфазная среда – смесь воды и пара, называемая влажным насыщенным паром. По мере подвода теплоты количество жидкой фазы уменьшается, а паровой – растет.
Температура смеси при этом остается неизменной и равной ts, так как теплота расходуется на испарение жидкой фазы. Следовательно, процесс парообразования на этой стадии является изобарно-изотермическим.
Наконец, последняя капля воды превращается в пар, и цилиндр оказывается заполненным только паром, который называется сухим насыщенным. Состояние его изображается точкой 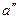 .
.
При сообщении сухому пару теплоты при том же давлении его температура будет увеличиваться, пар будет перегреваться. Точка а изображает состояние перегретого пара и в зависимости от температуры пара может лежать на разных расстояниях от точки 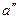 .
.
Если рассмотреть процесс парообразования при более высоком давлении, то можно заметить следующие изменения. Точка а0 остается почти на той же вертикали, так как вода практически несжимаема. Точка 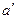 смещается вправо, ибо с ростом давления увеличивается температура кипения, а жидкость при повышении температуры расширяется. Что же касается пара (точка
смещается вправо, ибо с ростом давления увеличивается температура кипения, а жидкость при повышении температуры расширяется. Что же касается пара (точка 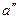 ), то, несмотря на увеличение температуры кипения, удельный объем пара все-таки падает из-за более сильного влияния растущего давления.
), то, несмотря на увеличение температуры кипения, удельный объем пара все-таки падает из-за более сильного влияния растущего давления.
Поскольку удельный объем жидкости растет, а пара падает, то при постоянном увеличении давления мы достигнем такой точки К, в которой удельные объемы жидкости и пара сравняются. Эта точка называется критической. В критической точке различия между жидкостью и паром исчезают. Для воды параметры критической точки составляют: 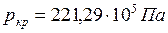 ;
; 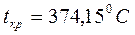 ;
; 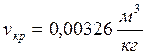 . При температурах, больших критической, возможно существование только одной фазы. Название этой фазы (жидкость или перегретый пар) в какой-то степени условно и определяется обычно ее температурой.
. При температурах, больших критической, возможно существование только одной фазы. Название этой фазы (жидкость или перегретый пар) в какой-то степени условно и определяется обычно ее температурой.
Наименьшим давлением, при котором еще возможно равновесие, воды и насыщенного пара, является давление, соответствующее тройной точке. Под последней понимается то единственное состояние, в котором могут одновременно находится в равновесии пар, вода и лед (точка 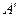 ) Параметры тройной точки для воды:
) Параметры тройной точки для воды: 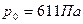 ;
; 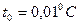 ;
; 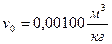 . Процесс парообразования, происходящий при абсолютном давлении
. Процесс парообразования, происходящий при абсолютном давлении 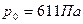 , показан на диаграмме
, показан на диаграмме  , которая практически совпадает с осью абсцисс. При более низких давлениях пар может сосуществовать лишь в равновесии со льдом (сублимация - процесс парообразования из льда).
, которая практически совпадает с осью абсцисс. При более низких давлениях пар может сосуществовать лишь в равновесии со льдом (сублимация - процесс парообразования из льда).
Если теперь соединить одноименные точки плавными кривыми, то получим:
1) нулевую изотерму I - каждая точка соответствует состоянию 1 кг воды при 0 0С и давлении р;
2) нижнюю пограничную кривую II – зависимость от давления удельного объема жидкости при температуре кипения ts;
3) верхнюю пограничную кривую III – зависимость удельного объема сухого насыщенного пара от давления.
Все точки горизонталей между кривыми II и III соответствуют состоянию влажного насыщенного пара, точки кривой II определяют состояние кипящей воды, точки кривой III – состояние сухого насыщенного пара. Влево от кривой II до нулевой изотермы I лежит область некипящей однофазной жидкости, вправо от кривой III – область перегретого пара.
Кривые II и III определяют область насыщенного пара, отделяя ее от области воды и перегретого пара. Их называют пограничными.
Дата добавления: 2015-08-11; просмотров: 1611;
