Уравнение состояния идеальных газов.
Идеальными газами называют такие, которые полностью подчиняются законам Бойля – Мариотта и Гей-Люссака. В идеальных газах отсутствуют силы взаимного притяжения и отталкивания между молекулами, а объем самих молекул пренебрежимо мал по сравнению с объемом газа.
Все реальные газы при высоких температурах и малых давлениях почти полностью подходят под понятие «идеальный газ» и практически по свойствам не отличаются от него. Состояние идеального газа – это предельное состояние реального газа, когда давление стремится к нулю 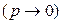 .
.
Закон Бойля – Мариотта устанавливает зависимость между удельным объемов и абсолютным давлением идеального газа в процессе при постоянной температуре. Закон Бойля – Мариотта гласит: при постоянной температуре объем, занимаемый идеальным газом, изменяется обратно пропорционально его давлению:
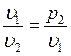
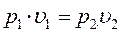 ,
, 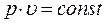
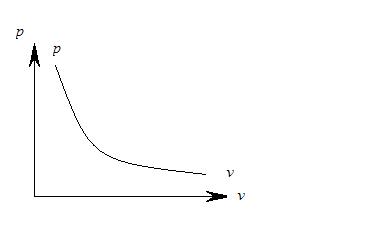
Рис. 1.6.1
Графически в системе координат  закон Бойля – Мариотта изображается равнобокой гиперболой (см. рис. 1.6.1). Эта кривая получила название изотермы, а процесс, протекающий при постоянной температуре, называется изотермическим.
закон Бойля – Мариотта изображается равнобокой гиперболой (см. рис. 1.6.1). Эта кривая получила название изотермы, а процесс, протекающий при постоянной температуре, называется изотермическим.
Закон Гей-Люссака гласит: при постоянном давлении объемы одного и того же количества идеального газа измеряются прямо пропорционально абсолютным температурам:
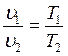
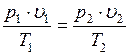 (1.6.1)
(1.6.1)
Выражение (1.6.1) показывает, что произведение удельного объема идеального газа на давление, деленное на абсолютную температуру, для любого равновесного состояния есть величина постоянная:
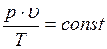 (1.6.2)
(1.6.2)
Постоянную величину обозначают R и называют удельной газовой постоянной:
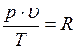
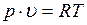 (1.6.3)
(1.6.3)
Уравнение (1.7.3) называют термическим уравнением состояния идеальных газов или характеристическим уравнением.
Для произвольного количества газа с массой т (кг) уравнение состояния имеет вид
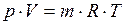
Удельная газовая постоянная имеет следующую единицу:
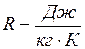
Молярной массой газа (вещества):
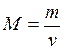
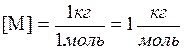
Напишем уравнение состояния для 1 моль газа:
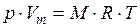
Произведение 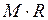 называют универсальной (молярной), газовой постоянной.
называют универсальной (молярной), газовой постоянной.
При так называемых нормальных физических условиях (давлении 101 325 Па и температуре 273,15 К) объем 1 моль газа равен 22,4143∙103 м3/моль, а универсальная газовая постоянна я оказывается равной
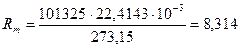 Дж/(моль∙К).
Дж/(моль∙К).
Универсальное уравнение состояния, отнесенное к 1 моль газа, имеет следующий вид:
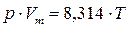 (1.6.4)
(1.6.4)
Дата добавления: 2015-08-11; просмотров: 1095;
