Противоположных направлениях.
Можно составить ряды закономерных изменений :
А. кислотные свойства : R-СООН > R-SH > R-OH > R-NH2
Б. основные свойства : R-NH2 > R-OH > R-SH
В амидах R-СОNH2аминогруппа практически теряет основные свойства.
Важное биологически активное вещество мочевина NH2 - CO - NH2 - однокислотное основание.
По современным данным протон присоединяется к атому кислорода и положительный.
заряд равномерно распределяется( делокализуется) между четырьмя атомами.
Мочевина – конечный продукт обмена пищевых белков, белков организма и аминокислот. Содержится во всех биологических жидкостях организма, стабилизирует структуры белков, нуклеиновых кислот, участвует в поддержании постоянства значения рН внутренней среды организма. Выделяется в составе мочи в количестве до
30 г/ сутки
R- С=О NH2 -C - NH2 + НNO3 —> NH2 -C - NH2
| || || . NO3 -
NH2 O + ОН
амид мочевина ( карбамид) соль нитрат мочевины
хорошо растворима плохо растворима
в воде
2.3. Медико- биологическое значение изучения темы « Кислотно-основные
свойства биоорганических соединений»
Теория Бренстеда-Лоури позволяет рассматривать большинство биоорганических соединений с позиций кислотно-основных свойств. В первую очередь, это касается полимеров белков, аминокислот, азотистых оснований, входящих в состав нуклеиновых кислот, биоактивных карбоновых кислот и их гетерофункциональных производных гидрокси – и оксокислот. Все вышеуказанные соединения изменяют внутреннюю среду организма, поэтому кровь, лимфа, слюна, моча и другие внеклеточные и внутриклеточные жидкости обладают буферной емкостью как в отношении кислот, так и оснований. В норме рН крови может изменяться в пределах 7,4 ± 0, 05. Накопление в составе крови 2-гидроксипропановой кислоты( молочной кислоты, лактата) сопровождается снижением значения рН – развивается ацидоз( его называют в медицине как « лактацидоз»). При заболеваниях печени возможно нарушение синтеза мочевины из аммиака, в крови накапливается аммиак, рН крови смещается в щелочную сторону, возникает алкалоз( алкали – араб- щелочь). Для обозначения увеличения содержания аммиака в крови в клинике используют термин « аммониемия, или «гипераммониемия».
Для проверки усвоения темы рекомендуем выполнить задания:
1. 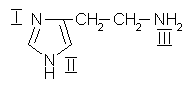
Сравните основность атомов азота в молекуле гистамина и запишите реакцию взаимодействия самого сильного основного центра с хлороводородной кислотой.
2. Составьте диаграммы распределения электронной плотности и сравните кислотность
двух природных соединений: 2-аминоэтанола-1( коламина ) и 2-аминоэтантиола-1 (меркамина).
Коламин входит в состав сложных липидов- фосфолипидов, в частности, кефалина. Меркамин использовался как лекарство -противолучевое средство-радиопротектор. Оба вещества образуются в клетках человека. Какое из этих соединений образует соль при взаимодействии с гидроксидом калия ?
НО - СН 2– СН2 - NН 2 НS- СН2 –СН2- N Н2
коламин меркамин
3. Составьте диаграммы распределения электронной плотности и сравните кислотность двух природных соединений: коламина и холина. Холин в нейронах превращается в ацетилхолин и является медиатором парасимпатической нервной системы и встречается в некоторых отделах симпатической нервной системы. Какое из этих двух соединений образует соль при взаимодействии с кислотой ? Объясните наличие положительного заряда на атоме азота в холине.
+
НО - СН 2– СН2 - NН 2 НО - СН 2– СН2 – N( СН 3) 3
коламин холин
4. Сравните основные свойства метиламина и аммиака ; пиридина и анилина. Напишите реакции образования хлороводородных солей аммиака, метиламина. анилина и пиридина.
5. Сравните кислотные свойства этанола и фенола. Объясните причину отличия кислотных свойств.
6. 2, 4, 6- тринитрофенол ( пикриновая кислота) образует соли с аминами и аминокислотами. Используется в анализе аминокислот.. Значение рКа равно 1, 02 . Можно ли сделать вывод, что нитрогруппы обладают сильным акцепторным
действием ?
7. Посмотрите в таблице значение рКа бензойной кислоты.
Кислотные свойства 4- замещенных бензойной кислоты зависят от природы заместителя. Значение рКа 4-гидроксибензойной кислоты равно 4, 58 , а 4-метилбензойной кислоты 4,34. Каким эффектом обладают эти две группы : донорным или акцепторным? Какая из двух групп оказывает большее влияние?
Информация
В таблице приведены значения величин рКа и рКв, которые помогут подтвердить основные положения о влиянии заместителей на кислотно-основные свойства. Эта таблица нужна также при изучении последующих тем.
КИСЛОТНО – ОСНОВНЫЕ СВОЙСТВА БИООРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Таблица
| Название | Структурная формула | |
| Органические кислоты | рКа | |
| Муравьиная кислота | НСООН | 3, 75 |
| Уксусная кислота | С Н3 -СООН | 4. 76 |
| Щавелевая кислота | НООС-СООН | 1,23 |
| Малоновая кислота | НООС-СН2 -СООН | 2, 8 |
| Янтарная кислота | НООС-СН2-СН2-СООН | 4, 17 |
| Бензойная кислота | С6 Н5 -СООН | 4, 19 |
| Фумаровая кислота Малеиновая кислота | НООССН=СН СООН | 3, 02 1, 92 |
| Метанол | С Н3 -ОН | 15,5 |
| Этанол | С 2 Н5 -ОН | 16, 0 |
| Фенол | С6 Н5 -ОН | 10, 0 |
| Органические основания | рК b | |
| Аммиак | NH3 | 4.75 |
| Метиламин | CН 3 -NH 2 | 3,36 |
| Этиламин | С2 Н5 - NH2 | 3,33 |
| Анилин | С6 Н5 - NH2 | 9,38 |
| Пиридин | С5 Н5 N | 8,96 |
| Мочевина | NH2 -С( О ) - NH2 | 1 3,9 |
Дата добавления: 2015-08-11; просмотров: 810;
