Влияние температуры на скорость химических реакций.
Закон Вант-Гоффа
При повышении t на каждые 10о скорость химической реакции увеличивается в 2-4 раза.

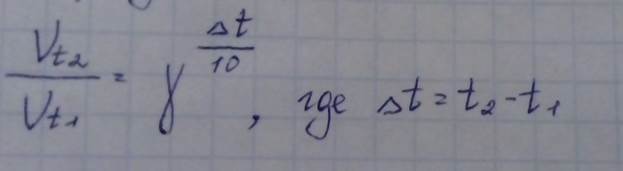 Энергия активации – та минимальная дополнительная энергия, которую необходимо собирать, молекулам сверх среднего ее значения.
Энергия активации – та минимальная дополнительная энергия, которую необходимо собирать, молекулам сверх среднего ее значения.
Уравнение Аррениуса:
 Влияние катализатора на скорость химических реакций
Влияние катализатора на скорость химических реакций
Катализаторы – это вещества, изменяющие скорость химических реакций, остающиеся при этом в химически неизменном виде.
Катализ – это процесс изменения скорости химических реакций под действием катализатора.
Катализ:
- гомогенный (катализатор и реагирующие вещества находятся в одной фазе)
- гетерогенный (катализатор и реагирующие вещества находятся в разных фазах)
Особенности биокатализаторов:
- высокая эффективность:
А) 2H2O2 → 2H2O + O2 (Ea = 75 кДж/моль)
Б) 2H2O2 → 2H2O + O2 (Ea = 23 кДж/моль)
V химической реакции увеличивается в 3*1011 раз
- ориентационный эффект (повышает скорость биохимических реакций примерно в 1000 раз)
- действует в условиях постоянных температур (10о-60оС)
- действие ферментов зависит от рН среды (рН = 4-10)
Механизм положительного действия катализатора
Роль катализатора – уменьшение Еа

 Смещение химического равновесия называется сдвигом химического равновесия.
Смещение химического равновесия называется сдвигом химического равновесия.
Дата добавления: 2015-08-11; просмотров: 1103;
