Функции коферментов и простетических групп
5.4.1 Коферменты и витамины. Коферменты – это органические вещества, предшественниками которых являются витамины. Некоторые из них непрочно связаны с белком (НАД, НSКоА, и др). есть ферменты, которые прочно связаны с апоферментом, т.е. представляют собой простетическую группу (гем и флавиновые коферменты).
Большинство коферментов не синтезируются в организме млекопитающих. Они должны поступать в организм с пищей (как правило, растительной). Однако в организм попадают не сами коферменты, а их предшественники — витамины. В клетке витамины модифицируются до коферментной формы. В настоящее время известно 13 витаминов (табл. 7), которые подразделяют на два типа: водорастворимые витамины и жирорастворимые витамины.
Таблица 7 - Характеристика основных коферментов по их функциям
| Коферменты | Тип реакции, в которой участвует кофермент, роль кофермента и участие активной группы в катализе | Витамин-предшественник |
| Биотицин | КарбоксилированиеПрисоединение карбоксильной группы путем замещения атома водорода у азота активной группой кофермента. Затем карбоксильная группа переносится на субстрат | Биотин (Витамин Н) |
| Кофермент (коэнзим) А (НSКоА) | Реакция ацилирования.Образование высокоэнергетической тиоэфирной группы с карбоксильными группами карбоновых кислот R-СО-SКоА | Пантотеновая кислота |
| Никотинамидадениндинуклеотид,(НАД) никотинамидадениндинуклеотидфосфат (НАДФ) – никотинамидные коферменты | Окислительно-восстановительные реакции. При окислении субстрата к пиридиновому кольцу присоединяются 1 протон (2-й переходит в среду) и 2 электрона, при этом положительный заряд утрачивается. | Никотинамид (витамин РР) |
| Пиридоксальфосфат (ПФ) | Трансаминирование, декарбоксилирование аминокислот. При сближении азота аминокислоты и углерода альдегидной группы ПФ образуется альдиминная связь. Далее после вутримолекулярных перестроек образуется аминогруппа на коферменте и кетогруппа на бывшей аминокислоте. | Пиридоксин (В6) |
| Тиаминпирофосфат (ТПФ) | Декарбоксилирование α-кетокислот. Разрывается связь, следующая за кетогруппой субстратов, высвобождается СО2, между кетогруппой субстрата и углеродом тиазолового кольца ТПФ образуется ковалентная связь. Это промежуточное соединение катализа. | Тиамин (В1) |
| Флавинмононуклеотид, (ФМН) флавин-адениндинуклеотид, (ФАД) - флавиновые коферменты | Окислительно-восстановительные реакции. Два атома водорода от субстрата присоединяются к атома азота N1 и N10 | Рибофлавин (В2) |
| Тетрагидрофолат | Перенос одноуглеродных групп | Фолиевая кислота |
5.4.2 Никотинамидные коферментыНАД+, НАДФ+
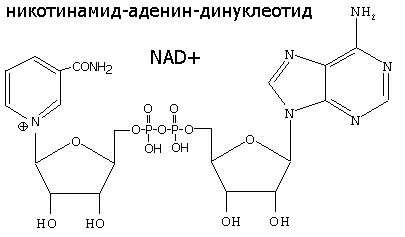
НАД+, НАДФ+-содержащие дегидрогеназы катализируют перенос гидрид-иона (Н-) от субстрата к никотинамидной части кофермента:
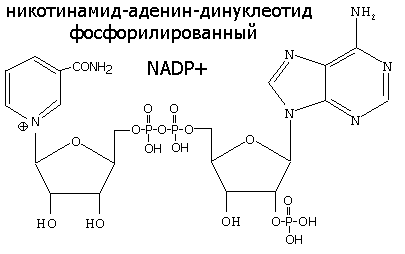
Восстановленная при этом часть кофермента отличается от окисленной только по производному никотиновой кислоты:
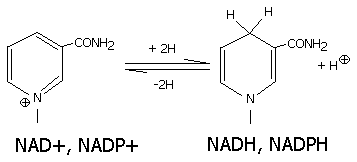
Восстановленные формы НАДН и НAДФH отсоединяются от апофермента и отделяются от дегидрогеназы. Затем они переносят гидрид ион на другую молекулу фермента (чаще всего- ФМН, ФАД-зависимого). Катализируют обратимые реакции окисления спиртов, оксикислот, аминов и др. Хорошо изучены ЛДН- лактатдегидрогеназа, MДH- малатдегидрогеназа, AДH- алкогольдегидрогеназа.
5.4.3 Флавиновые простетические группы.Окисленные формы флавиновых простетических групп выглядят следующим образом:
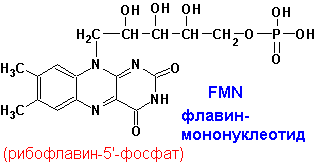

ФМН и ФAД катализируют переходы: спирты-альдегиды, амины-имины, НAДH, НAДФH-НAД+, НAДФ+. ФМН, ФAД- более сильные окислители. Сами передают гидрид ион непосредственно на кислород:
ФAДH2, ФMНH2 + O2 → ФAД, ФMН + H2O2
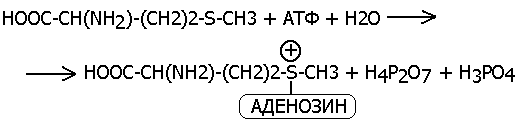
5.4.4 Нуклеозидтрифосфаты и нуклеозиддифосфат-сахара (НДФС)АТФ, УТФ, ГТФ, ЦТФ- коферменты фосфотрансфераз (перенос фосфата, пирофосфата, амф или аденозиновой части).
Перенос нуклеозида аденозин на метионин с молеклы АТФ выглядит следующим образом:
Дата добавления: 2015-08-11; просмотров: 5207;
