Коагуляция
Лиофобные коллоиды являются термодинамически неустойчивыми, существующими благодаря стабилизации за счет возникновения защитных ионных сил или молекулярных слоев, поэтому изменение состояния этих слоёв может привести к потере устойчивости и выпадению дисперсной фазы.
Коагуляция –процесс слипания коллоидных частиц с образованием более крупных агрегатов (что называется потерей агрегативной устойчивости) с последующей потерей кинетической устойчивости.
Коагуляция в разбавленных системах приводит к потере седиментационный устойчивости и к расслоению фаз.
К процессу коагуляции относят адагуляцию – агрегативное взаимодействие частиц дисперсной фазы с макроповерхностями.
Потеря агрегативной устойчивости приводит к коагуляции, первый этап которой состоит в сближении частиц дисперсной фазы и взсимной их фиксации на небольших расстояниях друг от друга. Между частицами остаются прослойки дисперсионной среды.
Флокуляция -это образование агрегатов из нескольких частиц, разделённых прослойками дисперсионной среды.
Коагуляция коллоидных растворов может быть вызвана следующими факторами:
- повышением температуры – увеличивается броуновское движение частиц, что способствует повышению кинетической устойчивости, это способствует более частым и эффективным столкновениям и преодолению сил отталкивания, следовательно, происходит слипание частиц, т.е. ведёт к понижению агрегативной устойчивости., одновременно снижается и кинетическая устойчивость;
- механическим воздействием (перемешиванием);
- объединением коллоидных систем с противоположным зарядом гранул;
- добавлением электролита.
Наиболее важным и изученным фактором коагуляции является действие электролита. Устанавливается ряд эмпирических закономерностей воздействия электролитов – правила коагуляции.
Правила коагуляции
1. Правило знака заряда. Любой электролит может вызвать коагуляцию дисперсной системы. Характер протекания определяется зарядом этой частицы.
2. Каждый электролит способен вызвать коагуляцию данного золя и мерой является порог коагуляции (γ) – та минимальная концентрация, которая вызывает явную коагуляцию. Из теории ДЛФО Дерягин и Ландау установили, что порог коагуляции определяется следующим уравнением:
 ,
,
где С – const; e - диэлектрическая постоянная; A – константа Гамакера; K - константа Больцмана; e – заряд электрона; z – заряд коагулирующего иона.
3. Правило валентности -правило Шульца – Гарди. Чем выше заряд коагулирующего иона, тем ниже порог коагуляции. Коагулирующая способность резко возрастает с увеличением заряда иона. Теория ДЛФО приводит к соотношению:
 или Сz6 = const
или Сz6 = const
или 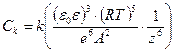 ,
,
где k – некоторый числовой множитель.
Таким образом, пороговая концентрация электролита обратно пропорциональна шестой степени заряда коагулирующего иона. Из чего следует, что соотношение пороговых концентраций для ионов разного заряда:
СI : CII : CIII = 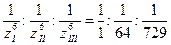 = 729:11:1
= 729:11:1
Одновалентный ион почти в 1000 раз эффективнее трёхвалентного иона.
На практике пороговая концентрация электролита определяется по следующей формуле:
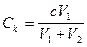 ,
,
где V1 – объём электролита, добавляемого в коллоидную систему, необходимый для начала коагуляции; V2 – начальный объем золя; с – концентрация электролита в добавляемом растворе.
Так, это явление проявляется при гипсовании солонцеватых почв (замене ионов Na+ на ионы Ca2+) и известковании кислых почв (замене ионов Н+ на ионы Ca2+). Коллоиды почв образуют при этом своеобразную микроструктуру: почва становится влагопроницаемой, увеличивается прочность ее структуры.
4. Лиотропные ряды или ряды Гофмейстера. Если коагулирующие ионы имеют одинаковый заряд, то большее коагулирующее действие будет иметь ион в большим радиусом (с меньшей степенью гидратации). В ряду неорганических ионов одинаковой зарядности коагулирующая активность увеличивается с уменьшением гидратации.

5. Связь коагуляции с величиной электрокинетического потенциала. Часто началу коагуляции соответствует снижение дзета-потенциала до критического значения. Слипание частиц имеет место при достижении ξ-потенциала 30 мВ.

Рис. 22. Зависимость электрокинетического потенциала от концентрации электролита.
В области очень маленьких концентраций ДЭС почти отсутствует. Система устойчива ниже критического значения дзета-потенциала.
а) Концентрационная коагуляция: с увеличением концентрации электролита ДЭС сжимается за счёт диффузных частиц и происходит коагуляция. При этом поверхностный заряд частиц и потенциал остаются незменными. Правило Шульце-Гарди применимо.

Рис. 23. Зависимость электропотенциала ДЭС от концентрации при концентрационной коагуляции.
б) Нейтрализационная коагуляция: добавляемые ионы электролита взаимодействуют с потенциалопределяющими ионами на поверхности частиц, связывая их в нерастворимое соединение, что понижает заряд и потенциал частиц. Это приводит к отклонению от правила Шулье-Гарди.

Рис.24. Зависимость электропотенциала ДЭС от концентрации при нейтрализационной коагуляции.
Влияние различных концентраций многозарядных ионов приводит к перезарядке золей явление непральных рядов коагуляции.
6. Коагулирующее действие органических ионов тем выше, чем выше адсорбционная способность.
Дата добавления: 2015-08-11; просмотров: 2602;
