Поверхностное натяжение на границе жидкость – газ
Дисперсные частицы и дисперсионная среда в лиофобных коллоидных системах всегда относятся к различным фазам.
Гетерогенная система, состоящая из 2-х фаз (чистая жидкость и ее собственный насыщенный пар) характеризуется тем, что жидкость на поверхности находится в особых условиях: молекулы жидкости испытывают неодинаковое влияние сил межмолекулярного взаимодействия, которое внутри каждой фазы полностью компенсируется, т.е. уравновешивается – испытывает одинаковое воздействие со всех сторон (молекулы А).
 |
Рис. 1. Гетерогенная система из 2-х фаз.
Таким образом, в поверхностном слое на границе с газом, силы взаимодействия со стороны жидкости значительно больше (молекулы В).
В результате избытка сил притяжения со стороны жидкости молекулы В стремятся втянуться внутрь жидкости, так поверхность раздела жидкости стремится к уменьшению.
Под влиянием поверхностного натяжения масса жидкости, при отсутствии внешних сил, всегда стремится принять форму шара, т.к. поверхность шара является наименьшей поверхностью, ограничивающей данный объём, и следовательно, поверхностная энергия системы при этом будет минимальной.
Например, в свободной капле стремление поверхности к уменьшению приводит к ее шарообразной форме.
Стремление к уменьшению площади поверхности фазы объясняется термодинамически.
Все самопроизвольные процессы происходят в направлении уменьшения энергии Гиббса, dG < 0, т.е. произведение σ·dS стремиться к минимальному значению, возможному для данной системы при сохранении ее объема – что невозможно. Вследствие этого дисперсные системы принципиально термодинамически неустойчивы.
Уменьшение свободной поверхностной энергии системы происходит самопроизвольно и может реализоваться двумя способами:
1) за счет уменьшения площади межфазной поверхности (например, в процессе коагуляции дисперсных систем – в туманах и дождевых облаках происходит слияние мелких капель, разрушается дисперсная система, в результате проливается дождь и появляется роса);
2) путем изменения состава поверхностного слоя – адсорбция.
Удельная свободная поверхностная энергия численно равна силе поверхностного натяжения.
С одной стороны, молекула из поверхности раздела стремиться внутрь. С другой стороны, молекулы из объема стремятся на поверхность, что требует затраты энергии, т.е. увеличение поверхности жидкости требует затраты энергии F – поверхностная энергия.
Поверхностная энергия равна работе сил поверхностного натяжения, которая необходима для перемещения 1 молекулы из объема на поверхность, умноженной на количество перемещенных молекул: F = n·σ.
Если работа по перемещению молекул производится в равновесных и изотермических условиях (dG < 0, ∆Т = const), величина F называется свободной поверхностной энергией.
Если работа по перемещению молекул отнесена к единице поверхности – поверхностное натяжение:
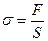 ,
,
где σ – поверхностное натяжение, F – поверхностная энергия, S – площадь поверхности.
При ∆Т = const и ∆р = const поверхностная энергия Гиббса dGs пропорциональна площади поверхности S: dGs = σ∙dS.
Поверхностное натяжение пропорционально внутреннему давлению, и следовательно, чем сильнее молекулярное взаимодействие, тем выше поверхностное натяжение.
Дата добавления: 2015-08-11; просмотров: 1961;
