Основные законы химии
§ 1. Атомно-молекулярное учение – теоретический фундамент химии.Вещество – есть одна из форм существования материи. Вещество состоит из отдельных мельчайших частиц – молекул, атомов, ионов, которые в свою очередь обладают определенным внутренним строением. То есть, всякое вещество не является чем-то сплошным, а состоит из отдельных очень малых частиц, в основе атомно-молекулярного учения лежит принцип дискретности (прерывности строения) вещества. Свойства веществ являются функцией их состава и строения образующих его частиц. Для большинства веществ эти частицы представляют собой молекулы.
Молекула – наименьшая частица вещества, обладающая его химическими свойствами. Молекулы в свою очередь состоят из атомов. Атом – наименьшая частица элемента, обладающая его химическими свойствами.
Необходимо различать понятия простого (элементарного) вещества и химического элемента. В самом деле, каждое простое вещество характеризуется определенными физическими и химическими свойствами. Когда какое-нибудь простое вещество вступает в химическую реакцию и образует новое вещество, то оно при этом утрачивает большинство своих свойств. Например, железо, соединяясь с серой, теряет металлический блеск, ковкость, магнитные свойства и др. Точно так же водород и кислород, входящие в состав воды, содержатся в воде не в виде газообразных водорода и кислорода с их характерными свойствами, а в виде элементов – водорода и кислорода. Если же эти элементы находятся в «свободном состоянии», т.е. не связаны химически ни с каким другим элементом, то они образуют простые вещества. Химический элемент можно определить как вид атомов, характеризующийся определенной совокупностью свойств. При соединении друг с другом атомов одного и того же элемента образуются простые вещества, сочетание же атомов различных элементов дает или смесь простых веществ, или сложное вещество.
Существование химического элемента в виде нескольких простых веществ называется аллотропией. Различные простые вещества, образованные одним и тем же элементом, называются аллотропическими видоизменениями этого элемента. Различие между простым веществом и элементом становится особенно ясным, когда мы встречаемся с несколькими простыми веществами, состоящими из одного и того же элемента. Различают аллотропию состава и аллотропию формы. Атомы одного и того же элемента расположенные в разном геометрическом порядке (аллотропия формы) или соединяющиеся в молекулы различного состава (аллотропия состава), образуют простые вещества с различными физическими свойствами при похожих химических свойствах. Пример: кислород и озон, алмаз и графит.
§ 2. Стехиометрические законы. Химический эквивалент.Основу атомно-молекулярного учения составляет основные законы химии, открытые на рубеже XVIII и XIX вв.
Закон сохранения масс и энергий,является основным законом естествознания.Впервые он был сформулирован и экспериментально обоснован
М.В. Ломоносовым в 1756-1759 гг., позднее он был открыт и подтвержден Лавуазье: масса образовавшихся продуктов реакции равна массе исходных реагентов. В математической форме можно записать
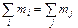 (2.1)
(2.1)
где i, j – целые числа, равные числу реагентов и продуктов соответственно.
В современном виде этот закон формулируют следующим образом: в изолированной системе сумма масс и энергий постоянна. На законе сохранения массы основаны изучение реакций между отдельными веществами и количественный химический анализ.
Закон взаимосвязи массы и энергии (Эйнштейн).Эйнштейн показал, что между энергией и массой существует взаимосвязь, количественно выражаемая уравнением:
Е = mc2 или Dm = DЕ/c2 (2.2)
где Е – энергия; m – масса; с – скорость света. Закон иллюстрируется и справедлив для ядерных реакций, в которых выделяется огромное количество энергии при небольших изменениях масс (атомный взрыв).
Закон постоянства состава (Пруст, 1801-1808): каким бы путем не было получено данное химически чистое соединение, состав его является постоянным.Так оксид цинка может быть получен в результате самых разнообразных реакций:
Zn + 1/2 O2 = ZnO; ZnСO3 = ZnO + СO2; Zn(OН)2 = ZnO + Н2О.
Но в химически чистом образце ZnO всегда содержится 80,34% Zn и 19,66% О.
Закон постоянства состава полностью выполняется для газообразных, жидких веществ и ряда твердых (дальтониды), но многие кристаллические вещества сохраняют свою структуру при переменном (в некоторых пределах) составе (бертоллиды). К ним относятся соединения некоторых металлов друг с другом, отдельные оксиды, сульфиды, нитриды. Следовательно, этот закон применим лишь для таких веществ, которые независимо от агрегатного состояния имеют молекулярную структуру. В соединениях переменного состава этот закон имеет границы применимости, в особенности для веществ, находящихся в твердом состоянии, так как носителем свойств в данном состоянии является не молекула, а некая совокупность ионов разных знаков, называемая фазой (однородная часть неоднородной системы, ограниченная поверхностью раздела), или иными словами кристаллические решетки твердых тел имеют дефекты (вакансии и включения узлов).
Закон эквивалентов (Рихтер, 1792-1800): химические элементы соединяются между собой в массовых отношениях, пропорциональных их химическим эквивалентам:
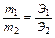 . (2.3)
. (2.3)
На основании этого закона проводятся все стехиометрические расчеты.
Химическим эквивалентом элемента называется такое его количество, которое соединяется с 1 молем (1,008 г) атомов водорода или замещает то же количество атомов водорода в химических соединениях.
Понятие об эквивалентах и эквивалентных массах распространяется также на сложные вещества. Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или вообще с одним эквивалентом любого другого вещества.
Расчет эквивалентов простых и сложных веществ:
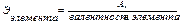 (2.4)
(2.4)
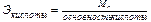 (2.5)
(2.5)
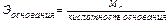 (2.6)
(2.6)
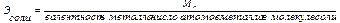 (2.7)
(2.7)
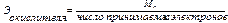 (2.8)
(2.8)
где Ar – атомная масса элемента; МА – молекулярная масса соединения.
Закон кратных отношении (Дальтон, 1808). Если два элемента образуют между собой несколько химических соединений, то количества одного из них, отнесенные к одному и тому же количеству другого, относятся как небольшие целые числа.
Поясним содержание закона на примере анализа соединений азота с кислородом: N2O, NO, N2O3, NO2, N2O5. Атомная масса азота 14, кислорода – 16. Количество кислорода, пошедшего на образование оксидов по отношению к 14 г азота: 8:16:24:32:40=1:2:3:4:5.
Закон Авогадро (1811).Это один из основных законов химии: в равных объемах газов при одинаковых физических условиях (давлении и температуре) содержится одинаковое число молекул.
Авогадро установил, что молекула газообразных веществ двухатомны, не H, О, N, Cl, а H2, О2, N2, Cl2. C открытием инертных газов – они одноатомны, обнаружилось исключения.
Первоеследствие: моль любого газа в нормальных условиях имеет объем, равный 22,4 л/моль.
Второеследствие:Плотности любых газов относятся как их молекулярные массы:d1/d2=M1/M2.
Постоянная Авогадро – число частиц, в 1 моле веществ 6,02×1023 моль-1.
Объяснение основных законов химии в свете атомно-молекулярной теории лежит в ее постулатах:
1) Атомы представляют собой мельчайшие частицы вещества, которые невозможно разделить на составные части (химическими способами) или превратить друг в друга, или уничтожить.
2) Все атомы одного элемента одинаковы и имеют одинаковую массу (если не учитывать существования изотопов, см. лекцию 3).
3) Атомы различных элементов имеют различные массы.
4) При химической реакции между двумя или большим числом элементов их атомы соединяются друг с другом в небольших целочисленных отношениях.
5) Относительные массы элементов, которые соединяются друг с другом, непосредственно связаны с массами самих атомов, т.е. если 1 г серы соединяется с 2 г меди, то это значит, что каждый атом меди весит вдвое больше, чем атом серы.
Одним словом химией «управляют» целые числа, поэтому все эти законы называют стехиометрическими. В этом – торжество атомно-молекулярного учения.
§ 3. Атомные и молекулярные массы. Моль.Рассмотрим в каких единицах выражают молекулярные и атомные массы. В 1961 г. принята единая шкала относительных атомныхмасс, в основу которой положена 1/12 часть массы атома изотопа углерода 12С, названная атомной единицей массы (а.е.м.). В соответствии с этим в настоящее время относительной атомной массой (атомной массой) элемента называют отношение массы его атома к 1/12 части массы атома 12С.
Аналогично, относительной молекулярной массой (молекулярной массой) простого или сложного вещества называют отношение массы его молекулы к 1/12 части массы атома 12С. Поскольку масса любой молекулы равна сумме масс составляющих ее атомов, то относительная молекулярная масса равна сумме соответствующих относительных атомных масс. Например, молекулярная масса воды, молекула которой содержит два атома водорода и один атом кислорода, равна: 1,0079×2+15,9994= 18,0152.
Наряду с единицами массы и объема, в химии пользуются также единицей количества вещества, называемой молем. Моль – количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
Количество вещества в молях равно отношению массы вещества m к его молекулярной массе M:
n = m/М (2.8)
Молярную массу (М) обычно выражают в г/моль. Молярная масса вещества, выраженная в г/моль, имеет то же численное значение, что и его относительная молекулярная (атомная) масса. Так, мольная масса атомарного водорода равна 1,0079 г/моль, молекулярного водорода – 2,0158 г/моль.
Зависимость объема газа от давления и температуры может быть описанауравнением состояния идеального газа pV = RT, справедливое для одного моля газа, а с учетом числа молей оно становится знаменитым уравнением
Клапейрона – Менделеева:
pV=nRT (2.9)
где R – универсальная газовая постоянная (8,31 Дж/моль×К).
С помощью этого уравнения и второго следствия из закона Авогадро, используя простые измерительные приборы: термометр, барометр, весы в конце XIX в. были определены молекулярные массы многих летучих простых и сложных органических и неорганических веществ. В 1860 г. на I международном конгрессе химиков (Карлсруэ, Германия) были приняты классические определения основных понятий: атома, молекулы, элемента и т.д., проведена систематика, классификация основных типов реакций и основных классов химических соединений.
§ 4. Основные классы неорганических соединений.Классификация простых и сложных химических веществ основана на рассмотрении реагентов и продуктов одной из основных химических реакций – реакции нейтрализации. Основы этой классификации были заложены Берцелиусом в 1818 г., в дальнейшем она была существенно уточнена и дополнена.
Еще алхимики объединили ряд простых веществ, обладающих похожими физическими и химическими свойствами, под названием металлы. Типичным металлам свойственны ковкость, металлический блеск, высокая тепло- и электропроводность, по химическим свойствам металлы являются восстановителями. Остальные простые вещества были объединены в класс неметаллов (металлоидов). Неметаллы отличаются более разнообразными физическими и химическими свойствами. При взаимодействии простых веществ с кислородом образуются оксиды. Металлы образуют основные оксиды, неметаллы – кислотные. В реакции таких оксидов с водой образуются, соответственно, основания и кислоты. Наконец, реакция нейтрализации кислот и оснований приводит к образованию солей. Соли также могут получаться при взаимодействии основных оксидов с кислотными оксидами или кислотами, кислотных оксидов – с основными оксидами или основаниями (табл. 2.1).
Таблица 2.1
Химические свойства основных классов неорганических соединений
| Металл | Основной оксид | Основание | Соль | |
| Неметалл | Fe + S =FeS | — | 2NaOH + Cl2 = NaCl + NaClO+H2O | 2NaBr + Cl2 = 2NaCl + Br2 |
| Кислотный оксид | — | CaO + CO2 = CaCO3 | 2NaOH + CO2 = Na2CO3 + H2O | — |
| Кислота | Fe + 2HCl = FeCl2 + H2 | CaO + H2SO4 = CaSO4 + H2O | NaOH + HCl = NaCl + H2O | BaCl2 + H2SO4 = BaSO4↓ + 2HCl |
| Соль | Zn + CuSO4= Cu + ZnSO4 | — | CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 | AgNO3 + NaCl = AgCl↓ + NaNO3 |
Следует подчеркнуть, что с водой непосредственно реагируют только те основные оксиды, которые образуют растворимые в воде основания – щелочи. Нерастворимые в воде основания (например, Cu(OH)2) могут быть получены из оксидов только в две стадии:
CuO + H2SO4 = CuSO4 + H2O, CuSO4 + 2NaOH = Cu(OH)2¯ + Na2SO4.
Классификация оксидов не исчерпывается основными и кислотными. Ряд оксидов и соответствующих им гидроксидов проявляют двойственные свойства: реагируют с кислотами как основания и с основаниями как кислоты (в обоих случаях образуются соли). Такие оксиды и гидроксиды называются амфотерными:
Al2O3+6HCl=2AlCl3+3H2O, Al2O3+2NaOH=2NaAlO2+H2O (сплавление тв. вещ-в),
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O, Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] (в р-ре).
Некоторым оксидам невозможно сопоставить соответствующие им кислоту или основание. Такие оксиды называются несолеобразующими, например, оксид углерода (II) CO, оксид азота (I) N2O. Они не участвуют в кислотно-основных взаимодействиях, но могут вступать в другие реакции. Так, N2O – сильный окислитель, CO – хороший восстановитель. Иногда кислотные, основные и амфотерные оксиды объединяют в класс солеобразующих.
Среди кислот выделяются бескислородные – например, хлороводородная (соляная) HCl, сероводородная H2S, циановодородная (синильная) HCN. По кислотно-основным свойствам они не отличаются от кислородсодержащих кислот. Существуют также вещества, обладающие основными свойствами, но не содержащие атомов металла, например, гидроксид аммония NH4OH – производное аммиака NH3.
По числу содержащихся в молекуле кислоты атомов водорода, способных замещаться атомами металла, различают кислоты одноосновные (например, хлороводород НСl, азотистая кислота НNО2), двухосновные (сернистая Н2SО3, угольная Н2СО3), трехоcновные (ортофосфорная Н3РO4).
Названия кислот производят от элемента, образующего кислоту. В случае бескислородных кислот к названию элемента (или группы элементов, например, СN – циан), образующего кислоту, добавляют суффикс «о» и слово «водород»: Н2S – сероводород, НСN – циановодород.
Названия кислородосодержащих кислот зависят от степени окисления кислотообразующего элемента. Максимальной степени окисления элемента соответствует суффикс «...н(ая)» или «...ов(ая)» например, НNО3 – азотная кислота, НСlO4 – хлорная кислота, Н2СrO4 – хромовая кислота). По мере понижения степени окисления суффиксы изменяются в следующей последовательности: «...оват(ая)», «...ист(ая)», «...оватист(ая)»; например, НСlO3 – хлорноватая, НСlO2 – хлористая, НОСl – хлорноватистая кислоты. Если элемент образует кислоты только в двух степенях окисления, то для названия кислоты, соответствующей низшей степени окисления элемента, используется суффикс «...ист(ая)»; например, НNО2 – азотистая кислота. Кислоты, содержащие в своем составе группировку атомов -O-O-, можно рассматривать как производные пероксида водорода. Их называют пероксокислотами (или надкислотами). В случае необходимости после приставки «пероксо» в названии кислоты помещают числительную приставку, указывающую число атомов кислотообразующего элемента, входящих в состав молекулы, например: H2SO5, H2S2O8.
Среди соединений важную группу образуют основания (гидроксиды), т.е. вещества, в состав которых входят гидроксильные группы ОН-. Названия гидроксидов образуются из слова «гидроксид» и названия элемента в родительном падеже, после которого, в случае необходимости, римскими цифрами в скобках указывается степень окисления элемента. Например, LiОН – гидроксид лития, Fe(ОН)2 – гидроксид железа (II).
Характерным свойством оснований является их способность взаимодействовать с кислотами, кислотными или амфотерными оксидами с образованием солей, например:
KOH + HCl = KCl + Н2O, Ва(ОН)2 + СО2 = ВаСО3 + Н2О
2NаОН + Аl2O3 = 2NаАlO2 + Н2О
С точки зрения протолитической (протонной) теории основаниями считают вещества, которые могут быть акцепторами протонов, т.е. способны присоединять ион водорода. С этих позиций к основаниям следует относить не только основные гидроксиды, но и некоторые другие вещества, например аммиак, молекула которого может присоединять протон, образуя ион аммония:
NH3 + H+ = NH4+
Действительно, аммиак, подобно основным гидроксидам, способен реагировать с кислотами с образованием солей:
NН3 + НСl = NH4Сl
В зависимости от числа протонов, которые могут присоединяться к основанию, различают основания однокислотные (например, LiОН, КОН, NН3), двухкислотные [Са(ОН)2, Fе(ОН)2] и т.д.
Амфотерные гидроксиды (Al(ОН)3, Zn(ОН)2) способны диссоциировать в водных растворах как по типу кислот (с образованием катионов водорода), так и по типу оснований (с образованием гидроксильных анионов); они могут быть как донорами, так и акцепторами протонов. Поэтому амфотерные гидроксиды образуют соли при взаимодействии как с кислотами, так и с основаниями. При взаимодействии с кислотами амфотерные гидроксиды проявляют свойства оснований, а при взаимодействии с основаниями – свойства кислот:
Zn(ОН)2 + 2НСl = ZnСl2 + 2Н2О, Zn(ОН)2 + 2NаОН = Nа2ZnО2 + 2Н2О.
Существуют соединения элементов с кислородом, которые по составу относятся к классу оксидов, но по своему строению и свойствам принадлежат к классу солей. Это так называемые пероксиды, или перекиси. Пероксидами называются соли пероксида водорода Н2О2, например, Nа2О2, СаО2. Характерной особенностью строения этих соединений является наличие в их структуре двух связанных между собой атомов кислорода («кислородный мостик»): -О-О-.
Соли при электролитической диссоциации образуют в водном растворе катион К+ и анион А–. Соли можно рассматривать как продукты полного или частного замещения атомов водорода в молекуле кислоты атомами металла или как продукты полного или частичного замещения гидроксогрупп в молекуле основного гидроксида кислотными остатками.
Реакция нейтрализации может протекать не до конца. В этом случае при избытке кислоты образуются кислые соли, при избытке основания – основные (соли, образующиеся при эквивалентном соотношении, называются средними). Понятно, что кислые соли могут быть образованы только многоосновными кислотами, основные соли – только многокислотными основаниями:
Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O, Ca(OH)2 + H2SO4 = CaSO4 + 2H2O,
2Ca(OH)2 + H2SO4 = (CaOH)2SO4 + 2H2O.
Среди многообразия и огромного количества химических реакций всегда присутствовала их классификация. Так с учетом развития химии выделяются три основных типа химических реакций:
1) кислотно-основного равновесия, частные случаи – нейтрализации, гидролиза, электролитической диссоциации кислот и оснований;
2) окислительно-восстановительные с изменением степени окисления атома, иона, молекулы. При этом различают стадии окисления, и восстановления как части одного процесса отдачи и присоединения электронов;
3) комплексообразования – присоединения определенного числа молекул или ионов к центральному атому или иону металла, который является комплексообразователем, а первые – лигандами, количество которых характеризуется координационным числом (n).
Согласно этим типам химических реакций классифицируются и химические соединения: кислоты и основания, окислители и восстановители, комплексные соединения и лиганды.
В более современной трактовке с учетом электронного строения атомов и молекул, реакции первого типа можно определить как реакции с участием и переносом протона, реакции второго типа – с переносом электрона, реакции третьего типа – с переносом неподеленной пары электронов. Количественной мерой реакций первого типа являются, например, рН, второго – потенциал (E, B), разность потенциалов (Δφ, В), а третьего, – например, реализация определенного координационного числа (n) химических (донорно-акцепторных) связей, энергия стабилизации лигандного поля центрального иона – комплексообразователя (ΔG, кДж/моль), константа устойчивости.
Лекция 3
Строение атома
§ 1. Развитие представлений о строении атома. Если бы в результате какой-то мировой катастрофы все накопленные человечеством научные знания оказались бы уничтоженными и к грядущим поколениям перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Этот вопрос поставил знаменитый американский физик, нобелевский лауреат Ричард Фейнман и сам дал на него такой ответ: это атомная гипотеза. Все тела состоят из атомов – маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому. Однако с этим утверждением, по существу, мог бы согласиться уже древнегреческий философ Демокрит, живший за 400 лет до н.э. По-видимому, мы знаем об атомах кое-что еще, если, в отличие от древних греков, смогли создать на основе своих знаний атомные бомбы и атомные электростанции.
До конца XIX в. полагали атом неделимой и не изменяющейся частицей. Но затем были открыты ряд явлений, которые были не объяснимы с этой точки зрения. Электрохимические исследования Дэви, Фарадея показали, что атом может нести положительный и отрицательный заряд, поскольку они выделяются на катоде или на аноде электролизера. Отсюда вытекала корпускулярность электрического заряда.
Совершенствуя методы возбуждения газов для получения их спектров, Крукс открыл так называемые катодные лучи (явление, реализуемое в современных телевизорах). При прохождении электрического тока через заключенный в трубку разреженный газ от отрицательного полюса (катода) исходит поток слабого света – катодный луч. Катодный луч сообщает отрицательный заряд телам, на которые он падает, и отклоняется в сторону приближенных к трубке положительно заряженных тел. Следовательно, катодный луч представляет собой поток отрицательно заряженных частиц.
Были также открыты явления термоэмиссии и фотоэмиссии (Столетов), состоящие в выбивании отрицательно заряженных частиц под влиянием температуры и квантов света, подтвердившие тот факт, что в составе атома есть отрицательно заряженные частицы. Беккерель открыл явление радиоактивности. Супруги Кюри показали, что поток радиоактивного излучения неоднороден, и его можно разделить электрическим и магнитным полем. Общее излучение при попадании в конденсатор разделяется на три части: a-лучи (Не2+) немного отклоняются к отрицательной пластине конденсатора, b-лучи (поток электронов) сильно отклоняются к положительной пластине конденсатора, g-лучи (электромагнитные волны) не отклоняются ни электрическим, ни магнитным полем.
И, наконец, открытие рентгеновских лучей Конрадом Рентгеном показало, что атом сложен и состоит из положительных и отрицательных частиц, наименьшую из которых Томсон назвал электроном. Более того, Малликен измерил её заряд е = -1,6×10-19 Кл (минимально возможный, т.е. элементарный) и нашел массу электрона m = 9,11×10-31 кг.
Нейтральность атома при наличии в нем электронов приводила к выводу о существовании в атоме области, несущей положительный заряд. Остался открытым вопрос о местонахождении или размещении в атомах электронов и предполагаемых положительных зарядов, то есть вопрос о строении атома. На основании вышеприведенных исследований в 1903 г. Томсон предложил модель атома, которая была названа «пудинг с изюмом», положительный заряд в атоме распределен равномерно с вкрапленным в него отрицательным зарядом. Но дальнейшие исследования показали несостоятельность этой модели.
Резерфорд (1910 г.) пропускал через слой вещества (фольга) поток a-лучей и измеряя отклонение отдельных частиц после прохождения через фольгу. Обобщая результаты наблюдений Резерфордом было установлено, что тонкий металлический экран отчасти прозрачен для a-частиц, которые, проходя через листок, либо не изменяли своего пути, либо отклонялись на малые углы. Отдельные же a-частицы отбрасывались назад, как мячик от стены, будто встречали на своем пути непреодолимое препятствие. Так как отбрасывалось назад весьма небольшое число проходящих через фольгу a-частиц, то это препятствие должно занимать в атоме объем, неизмеримо малый даже по сравнению с самим атомом, при этом оно должно обладать большой массой, так как в противном случае a-частицы от него не рикошетировали бы. Таким образом, появилась гипотеза о ядре атома, в котором сосредоточена практически вся масса атома и весь положительный заряд. При этом становятся понятными отклонения пути большинства a-частиц на небольшие углы, под влиянием сил электростатического отталкивания со стороны атомного ядра. В дальнейшем было установлено, что диаметр ядра порядка 10–5 нм, а диаметр атома – 10–1 нм, т.е. объем ядра в 1012 раз меньше объема атома.
В модели атома, предложенной Резерфордом, в центре атома расположено положительно заряженное ядро, а вокруг него движутся электроны, число которых равно величине заряда ядра или порядковому номеру элемента, подобно планетам вокруг Солнца (планетарная модель атома). Развитая Резерфордом ядерная модель была крупным шагом вперед в познании строения атома. Она была подтверждена большим числом экспериментов. Однако в некоторых отношениях модель противоречила твердо установленным фактам. Отметим два таких противоречия.
Во-первых, планетарная модель атома Резерфорда не могла объяснить устойчивости атома. По законам классической электродинамики электрон, двигаясь вокруг ядра, неизбежно теряет энергию. С уменьшением запаса энергии у электрона радиус его орбиты должен непрерывно уменьшаться и в результате упасть на ядро и прекратить свое существование. Физически же атом представляет собой устойчивую систему и может существовать, не разрушаясь, чрезвычайно долго.
Во-вторых, модель Резерфорда приводила к неправильным выводам о характере атомных спектров. Спектры щелочных металлов оказываются сходными со спектром атомарного водорода, и анализ их приводил к заключению о наличие в составе атомов каждого щелочного металла одного электрона, слабо связанного с ядром по сравнению с остальными электронами. Т.е. в атоме электроны размещаются на не одинаковом расстоянии от ядра, а слоями.
В рентгеновских спектрах для различных элементов Мозли обнаружил, что 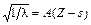 , где A – коэффициент пропорциональности, Z – порядковый номер (число электронов в атоме), l – длина волны, s – постоянная экранирования.
, где A – коэффициент пропорциональности, Z – порядковый номер (число электронов в атоме), l – длина волны, s – постоянная экранирования.
Таким образом, Мозли показал взаимосвязь положительного заряда ядра и номера элемента в Периодической системе. Чедвик измерил заряды ядер с помощью рассеивания a-частиц тонкими частицами серебра и платины и подтвердил, что положение элементов в периодической таблице определяется порядковым номером – зарядом ядра в атоме.
Атомные спектры получают, пропуская излучение возбужденных атомов (в пламени с высокой температурой или другими способами) через специальное оптическое устройство (призму, систему призм или дифракционных решеток), которое разлагает сложное излучение на монохроматические составляющие с определенной длиной волны (l) и, соответственно, с определенной частотой колебаний электромагнитного излучения: n=с/l, где c – скорость света. Каждый монохроматический луч регистрируется в определенном месте принимающего устройства (фотопластинки или др.). В результате получается спектр данного излучения. Атомные спектры состоят из отдельных линий – это линейчатые спектры.
Каждый вид атомов характеризуется строго определенным расположением линий в спектре, не повторяющихся у других видов атомов. Именно на этом основан метод спектрального анализа, с помощью которого были открыты многие элементы. Линейчатость атомных спектров противоречила законам классической электродинамики, согласно которой спектр атомов должен быть непрерывным в результате непрерывного излучения электроном энергии.
§ 2. Модель строения атома водорода Бора. Так как законы классической электродинамики оказались не применимы для описания поведения электрона в атоме, Нильс Бор впервые сформулировал постулаты, основанные на законах квантовой механики.
1) В атоме водорода существуют орбиты, двигаясь по которым, электрон не излучает. Они называются стационарными.
2) Излучение или поглощение энергии происходит в результате перехода электрона с одной стационарной орбиты на другую. Удаленные от ядра орбиты характеризуются большим запасом энергии. При переходе от низших к высшим орбитам атом переходит в возбужденное состояние. Но в этом состоянии он может находиться недолго. Он излучает энергию и возвращается на исходное основное состояние.
При этом энергия кванта излучения равна:
hn = En – Ek,
где n и k – целые числа.
3) Стационарными являются орбиты, для которых выполняется условие 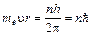 , где me – масса электрона, u – скорость вращения, r – радиус орбиты, h – постоянная Планка, n = 1,2,3,…,¥.
, где me – масса электрона, u – скорость вращения, r – радиус орбиты, h – постоянная Планка, n = 1,2,3,…,¥.
Пользуясь постулатами Бора и законами классической физики, можно рассчитать энергии орбит и частоты энергетических переходов: 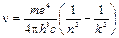 , где
, где 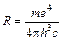 – константа Ридберга, а n и k целые числа, характеризующие номера (энергию) орбит. И как выяснилось дальше – квантовые числа.
– константа Ридберга, а n и k целые числа, характеризующие номера (энергию) орбит. И как выяснилось дальше – квантовые числа.
Таким образом, модель Бора хорошо объясняла происхождение спектров. Спектры бывают излучения и поглощения (рис. 3.1). В результате переходов атомов образуются группы спектральных линий. 1 – Лаймана, 2 – Бальмера,
3 – Пашена и т.д. Но расщепление спектральных линий не объясняется постулатами Бора и теорией Резерфорда. Эта теория хорошо объясняла свойства атома водорода (см. Приложение), но оказалась малопригодной для объяснения строения сложных атомов, начиная с гелия.
Рис. 3.1. Орбиты Бора для атома водорода.
§ 3. Основные положения волновой (квантовой) механики. Объяснение волновых (спектральных) свойств возникло одновременно с квантово-механическими представлениями в теории строения атома. Предпосылкой являлась теория Планка излучения тел. Он показал, что изменение энергии происходит не непрерывно (согласно законам классической механики), а скачкообразно, порциями, которые были названы – квантами. Энергия кванта определяется уравнением Планка: E = hn, где h – постоянная Планка равная 6,63×10–34 Дж×с,
n – частота излучения. Получается, что электрон обладает корпускулярными свойствами (масса, заряд) и волновыми – частота, длина волны.
В связи с этим Луи де Бройль выдвинул идею одуализме частиц и волн. Причем корпускулярно-волновой дуализм характерен для всех объектов микро- и макромира, только для макроскопических объектов преобладает один из наборов свойств, и мы говорим о них, как о частицах или волнах, а для элементарных частиц и те, и другие свойства проявляются совместно. Уравнение де Бройля показывает связь между импульсом частицы и длиной волны: 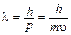 . Таким образом, электрону, вращающемуся вокруг ядра, можно приписать некоторую длину волны. Парадокс! Применение теории де Бройля к постулатам Бора позволяет предположить, что состояние атома устойчиво в том случае, если на его орбите укладывается целое число длин волн (стоячих, как на гитаре, с той лишь разностью, что концы струн как бы соединены в замкнутом пространстве).
. Таким образом, электрону, вращающемуся вокруг ядра, можно приписать некоторую длину волны. Парадокс! Применение теории де Бройля к постулатам Бора позволяет предположить, что состояние атома устойчиво в том случае, если на его орбите укладывается целое число длин волн (стоячих, как на гитаре, с той лишь разностью, что концы струн как бы соединены в замкнутом пространстве).
Принцип неопределенности Гейзенберга. Если электрон обладает двойственной природой, то нельзя одновременно определить его координату и импульс: Dx×Dp ³ h или DE×Dt ³ h, иными словами, для того чтобы электрон, перешел с одного энергетического уровня на другой, необходим квант энергии DE ³ hn.
Согласно этим представлениям электрон – облако, размазанное в объеме атома, имеющее разную плотность. Следовательно, для описания положения электрона в атоме требуется ввести вероятностное описание электронной плотности в атоме, учитывающее его энергию и пространственную геометрию. Это и было сделано Э. Шрёдингером. Он ввел знаменитое уравнение, описывающее поведение электрона в атоме волновой функцией (пси-функция y). Квадрат ее модуля |y|2, вычисленный для определенного момента времени и определенной точки пространства, дает плотность вероятности обнаружения частицы в этой точке в данное время. Функцию y (предложенную Шрёдингером) можно определить путем решения квантово-механического уравнения Шрёдингера. Это уравнение в простейшем случае частицы, движущейся в потенциальном поле, может быть записано в виде:
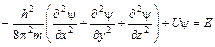 (3.1)
(3.1)
где m – масса частицы, U – потенциальная энергия, E – полная энергия, x, y, z – декартовы координаты. Решение этого уравнения возможно лишь при определенных значениях полной энергии E=T+U, (T, U –кинетическая, потенциальная энергии соответственно), причем T = mu2/2. Уравнение – феноменологическое, настолько интересно, что его целесообразно вывести, взяв за основу уравнение синусоиды: y(x) = sin(2px/l), проведя двойное дифференцирование, получим
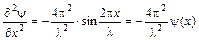 , (3.2)
, (3.2)
зная, что l = h/mu, подставив в уравнение (3.2) получим
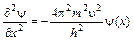 ,
, 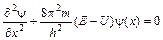 .
.
Введя, оператор Лапласа, учитывающего распределение волны в трехмерном пространстве: 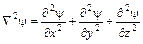 , получим уравнение Шрёдингера:
, получим уравнение Шрёдингера: 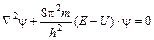 . Значение функции y не имеет строгого физического смысла (уравнение убывающей экспоненты). А вот, произведение |y|2dV – характеризуют вероятность нахождения электрода в объеме пространства dV. Обычно записывают для электронной плотности r = 4pr2|y|2dr – вероятность того, что электрон находится на расстоянии r от ядра. Для атома водорода, путем решения этого уравнения получена зависимость электронной плотности от расстояния (рис. 3.2), имеющей вероятностный характер и достигает максимального значения на некотором конечном расстоянии от ядра, соответствующего Боровскому радиусу. Различная плотность вероятности дает представление об электроне, как бы «размазанном» вокруг ядра в виде так называемого электронного облака, или орбитали. Чем больше величина, тем больше вероятность нахождения электрона в данной области атомного пространства. Величина и форма части пространства, в которой вероятность пребывания электрона максимальна (95% или 99%), называется орбиталью. Максимум плотности вероятности отвечает Боровским орбитам (рис. 3.2).
. Значение функции y не имеет строгого физического смысла (уравнение убывающей экспоненты). А вот, произведение |y|2dV – характеризуют вероятность нахождения электрода в объеме пространства dV. Обычно записывают для электронной плотности r = 4pr2|y|2dr – вероятность того, что электрон находится на расстоянии r от ядра. Для атома водорода, путем решения этого уравнения получена зависимость электронной плотности от расстояния (рис. 3.2), имеющей вероятностный характер и достигает максимального значения на некотором конечном расстоянии от ядра, соответствующего Боровскому радиусу. Различная плотность вероятности дает представление об электроне, как бы «размазанном» вокруг ядра в виде так называемого электронного облака, или орбитали. Чем больше величина, тем больше вероятность нахождения электрона в данной области атомного пространства. Величина и форма части пространства, в которой вероятность пребывания электрона максимальна (95% или 99%), называется орбиталью. Максимум плотности вероятности отвечает Боровским орбитам (рис. 3.2).
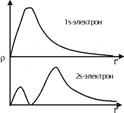
| Рис. 3.2. Функция радиального распределения для 1s- и 2s-электронов. |
Формы, размеры и число орбиталей будут подробнее рассмотрены при изучении теории химической связи. В общем, существуют s-, p-, d-орбитали имеющие форму соответственно сферы, гантели (объемной восьмерок) и пропеллера (объемного четырехлистника) соответственно (рис. 3.3).
Важной особенностью электронного строения атома является взаимодействие различных s-, p-, d-, f-орбиталей с близкой энергией (n) и геометрией (l), приводящих к образованию гибридных орбиталей. Явление гибридизации мы рассмотрим в теме «химическая связь».
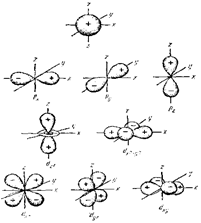
Рис. 3.3. Формы s-, p- и d-орбиталей. Показаны знаки волновой функции.
§ 4. Квантовые числа. Орбитали. Для объяснения электронного строения атома водорода предложены четыре квантовых числа n, l, ml, s характеризующие энергетическое состояние и поведение электрона в атоме. Эти числа однозначно характеризуют состояние электрона любого атома периодической системы элементов. Для каждого электрона они в совокупности имеют различные значения.
Главное квантовое число п – характеризует энергию и размеры электронных облаков. Оно принимает значения для основных состояний атомов 1-8 и в принципе до бесконечности. Его физический смысл, как номера энергетического уровня – значение энергии электрона в атоме и как следствие, размер атома. При п=1 электрон находится на первом энергетическом уровне с полной минимальной энергией и так далее. При увеличении п полная энергия увеличивается. Энергию каждого энергетического уровня можно оценить по формуле: Е=-1/13,6×n2. Энергетические уровни обозначают обычно буквами следующим образом:
| Значение (n) | |||||
| Обозначения | K | L | M | N | Q |
Побочное, орбитальное (или азимутальное) квантовое число l характеризует форму электронных орбиталей (облаков) вокруг атома и определяет изменение энергии в пределах энергетического уровня, то есть характеризует энергию подуровня. Каждой форме электронного облака соответствует определенное значение механического момента движения электрона, определяемого побочным квантовым числом l, которые изменяется в пределах от 0 до п–1: п=1, l=0; п=2, l=0, l=1; п=3, l=0, l=1, l=2 и т.д. Энергетические подуровни в зависимости от l обозначают буквами:
| Значения (l) | ||||||
| Обозначения (V) | s | p | d | f | g | h |
Те электроны, которые находятся на s уровне называются s-электронами, на p уровне p-электронами, на d уровне d-электронами.
Энергия электронов зависит от внешнего магнитного поля. Эта зависимость описывается магнитным квантовым числом. Магнитное квантовое число ml указывает на ориентацию в пространстве электронной орбитали (облако). Внешнее электрическое или магнитное поле изменяет пространственную ориентацию электронных облаков, при этом происходит расщепление энергетических подуровней. Число ml изменяется в пределах от –l, 0, +l и может иметь (2×l+1) значений:
| Электроны | s | p | d |
| Уровни | n=1, l=0, m=0 | n=2, l=1, m=-1, 0, +1 | n=3, l=2, m=-2,–1,0,+1,+2 |
Совокупность трех квантовых чисел однозначно описывает орбиталь. Она обозначается как «квадратик» – . Электрон, как частица, испытывает вращение вокруг собственной оси – по часовой и против часовой стрелки. Оно описывается спиновым квантовым числом s (ms), которое принимает значения ±1/2. Наличие в атоме электронов с противоположно направленными спинами обозначается как «стрелки». И так четверка наборов квантовых чисел описывает энергию электронов.
§ 5. Многоэлектронные атомы. Определение числа электронов на уровнях и подуровнях.В многоэлектронных атомах электронное построение в соответствие с набором квантовых чисел регулируется двумя постулатами.
Принцип Паули: В атоме не может быть двух электронов, обладающих 4 одинаковыми квантовыми числами (иначе они не различимы, минимальное энергическое различие в спинах). Следствие, в одной электронной ячейке, орбитали может быть не более двух электронов с разнонаправленными спинами.
Заполнение электронами ячеек осуществляется в соответствии с правилом Гунда. Электроны заполняют s-, p-, d-, f-орбитали таким образом, чтобы суммарный спин был максимальным или, иными словами, электроны стремятся заполнить вакантные (пустые) орбитали, а уж потом спариваться (по Паули):
| | | | | | ¯ | ¯ | | | |
Так, что с учетом принципов квантовой химии можно построить электронную конфигурацию любого атома, как это следует из табл. 3.1. Из табл. 3.1 выводим формулы для определения числа электронов на уровне 2n2, на подуровне 2(2l+1). Число орбиталей равно числу значений m (m=1, m=2, m=3).
Заполнение электронами подуровней осуществляется в соответствии с правилом Клечковского. Заполнение энергетических уровней происходит в порядке возрастания суммы главного и побочного квантовых чисел n+l.
Если эта сумма имеет одинаковые значения, то заполнение осуществляется в порядке возрастания n. Подуровни заполняются в порядке возрастания энергии:
1s << 2s << 2p << 3s << 3p << 4s £ 3d << 4p << 5s £ 4d << 5p << 6s £ 4f £ 5d…
Таблица 3.1
Дата добавления: 2015-08-11; просмотров: 703;
