Ненасыщенных карбоновых кислот
| Кислоты | Плотность,г/см3 | Температура, оС | Иодное число | ||
| кипения | вспышки | самовоспламенения | |||
| Акриловая (С2Н3СООН) | 1,062 | 1,41 | |||
| Олеиновая (С17Н33СООН) | 0,891 | 89,96 | |||
| Линолевая (С17Н31СООН) | 0,900 | - | - | 181,20 | |
| Линоленовая (С17Н29СООН) | 0,910 | - | - | 273,80 |
Лекция: Углеводы
Углеводами называют природные органические соединения, имеющие, как правило, общую формулу СmН2nОn (Сm(Н2O )n), где т и n і 3. Исключение составляют дезоксисахара, которые имеют общую формулу СmН2п+2On.
В зависимости от способности к гидролизу все углеводы делятся на:
моносахариды — углеводы, молекулы которых не подвержены гидролизу;
олигосахариды — углеводы, из молекул которых при гидролизе образуется от двух до десяти одинаковых или различных моносахаридов;
полисахариды — углеводы, из молекул которых при гидролизе образуется от десятков тысяч и выше одинаковых или различных моносахаридов.
Углеводы — распространенный в природе класс органических соединений.
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
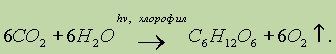
Моносахариды.Моносахариды по числу углеродных атомов в молекуле делятся на: триозы (С3Н6О3), тетрозы (С4Н8О4), пентозы (С5Н10О5), гексозы (С6Н12О6), гептозы (С7Н14О7) и октозы (С8Н16О8).
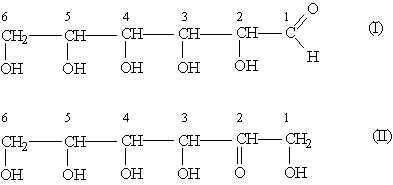
Моносахариды — дифункциональные соединения, так как в составе каждой молекулы содержатся несколько гидроксильных групп и одна карбонильная. В зависимости от природы карбонильной группы (альдегидная или кетонная) моносахариды делятся на альдозы и кетозы. Так, моносахарид гексоза существует в виде двух структурных изомеров — альдогексозы (I) (глюкоза) и кетогексозы (II) (фруктоза):
Изомерия моносахаридов обусловлена: 1) наличием альдегидной или кетонной группы; 2) наличием асимметрических атомов углерода; 3) существованием таутомерии.
Моносахариды, как и другие соединения с асимметрическими атомами углерода, существуют в виде двух оптических изомеров — D- и L-форм. Отнесение к D- и L-формам производят по расположению гидроксильной группы у атома углерода, соседнего с первичной спиртовой группировкой:

Все моносахариды существуют в виде двух таутомерных форм: открытой, или ациклической, и закрытой, или циклической. Циклическая форма образуется в результате внутримолекулярного взаимодействия альдегидной (кетонной) группировки с одним из гидроксидов (см. “Альдегиды и кетоны”).
Наибольшей устойчивостью обладают шести- и пятичленные циклы, называемые соответственно пиранозными и фуранозными циклами. Схема образования пиранозного цикла:
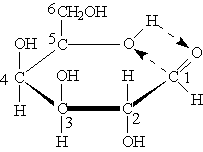
Атом водорода гидроксильной группы присоединяется к атому кислорода альдегидной группировки за счет разрыва p -связей. При этом образуется так называемый полуацетальный (см. “Альдегиды и кетоны”) или гликозидный гидроксил. После переноса атома водорода от гидроксильной группы на альдегидную атом кислорода соединяется с атомом углерода с образованием цикла. В результате циклизации в молекуле моносахарида появляется дополнительный асимметрический атом углерода.
Образующиеся циклические формы отличаются друг от друга расположением полуацетального гидроксила. К a -изомерам относят моносахариды, у которых гликозидный гидроксил находится под плоскостью кольца, к b -изомерам — моносахариды, у которых полуацетальный гидроксил находится над плоскостью кольца.
Получение: 1. Выделение моносахаридов, встречающихся в овощах и фруктах. 2. Гидролиз полисахаридов. 3. Синтез гексоз из формальдегида:
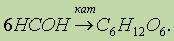
Реакция была впервые изучена А. М. Бутлеровым. В результате реакции образуется смесь различных трудноразделяемых гексоз.
Физические свойства. Моносахариды — бесцветные кристаллические вещества, плавящиеся с разложением, хорошо растворимые в воде, в растворах вращающие поляризованный свет, сладкие на вкус.
Химические свойства. Многообразие химических свойств моносахаридов объясняется их дифункциональностью.
1. Реакции образования эфиров. Моносахариды способны образовывать простые и сложные эфиры. Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила:
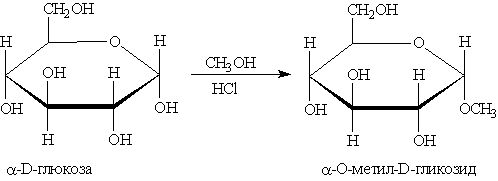
Простые эфиры получили название гликозидов. В более жестких условиях возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами, например:
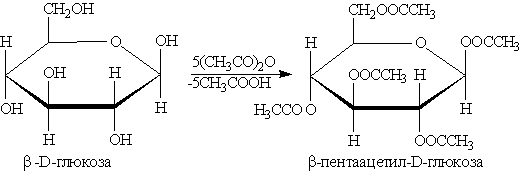
Большое значение имеют эфиры фосфорной кислоты рибозы и дезоксирибозы, являющиеся структурными фрагментами РНК и ДНК (см. “Азотсодержацие соединения”).
2. Реакция комплексообразования с гидроксидом меди (II). При взаимодействии свежеосажденного гидроксида меди (II) с моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета (см. “Спирты. Фенолы”).
3. Окислительно-восстановительные реакции (ОВР). При каталитическом гидрировании моносахаридов происходит восстановление карбонильной группы до спиртового гидроксила:
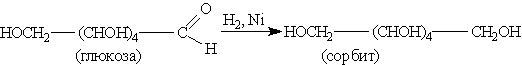
Бромная вода окисляет альдегидную группировку до карбоксильной:
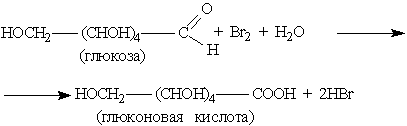
ОВР с оксидом серебра (I) и гидроксидом меди (II) используют как качественные реакции на альдозы и кетозы:
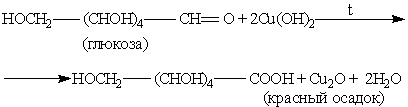

Кетозы дают те же самые реакции, так как в щелочной среде происходит их изомеризация в альдозы.
4. Реакция брожения. Моносахариды (например, глюкоза) способны расщепляться в зависимости от природы фермента до этанола, масляной или молочной кислоты:
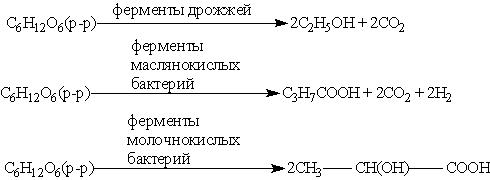
Отдельные моносахариды.Глюкоза — бесцветное кристаллическое вещество, сладкое на вкус, хорошо растворимое в воде.
В организме человека и животных глюкоза подвергается ферментативному окислению, конечными продуктами которого являются оксид углерода(IV) и вода:
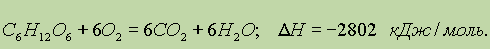
Фруктоза — структурный изомер глюкозы. Кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза. В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы обусловлены наличием кетонной и пяти гидроксильных групп.
Дезоксирибоза — бесцветное кристаллическое вещество, хорошо растворимое в воде. В виде фуранозной формы входит в состав ДНК. Как и другие моносахариды, дезоксирибоза в растворе существует в ациклической и циклической формах, способна образовывать простые и сложные эфиры, принимает участие в ОВР и реакциях комплексообразования.
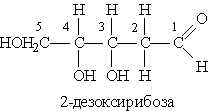
Рибоза — бесцветное кристаллическое вещество, хорошо растворимое в воде. В виде фуранозной формы входит в состав РНК. Химические свойства рибозы обусловлены наличием альдегидной и гидроксильных групп. При восстановлении рибозы образуется спирт —рибит НОСН2—(СНОН)3—СН2ОН, а при окислении — рибоновая кислота НОСН2—(СНОН)3—СООН. В растворе рибоза существует в ациклической и циклической формах:
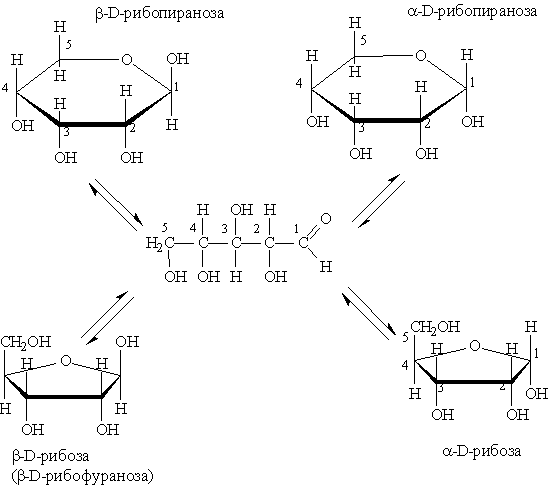
Получают рибозу гидролизом мононуклеотидов.
Олигосахариды.Наиболее изученными олигосахаридами являются дисахариды, которые широко распространены в природе. Они содержатся во многих плодах и овощах, сахарной свекле, сахарном тростнике, меде.
Получение. Дисахариды получают из природных источников: сахарозу из сахарной свеклы или сахарного тростника, мальтозу — ферментативным гидролизом крахмала, лактозу — из коровьего молока, целлобиозу — гидролизом целлюлозы.
Физические свойства. Дисахариды — бесцветные кристаллические вещества, хорошо растворимые в воде (исключение составляет лактоза), сладкие на вкус. Различают два вида дисахаридов.
1. Простые эфиры (гликозиды), образующиеся за счет взаимодействия полуацетального гидроксила одной из молекул моносахарида и одного из спиртовых гидроксилов (чаще всего у четвертого атома углерода) другой молекулы:
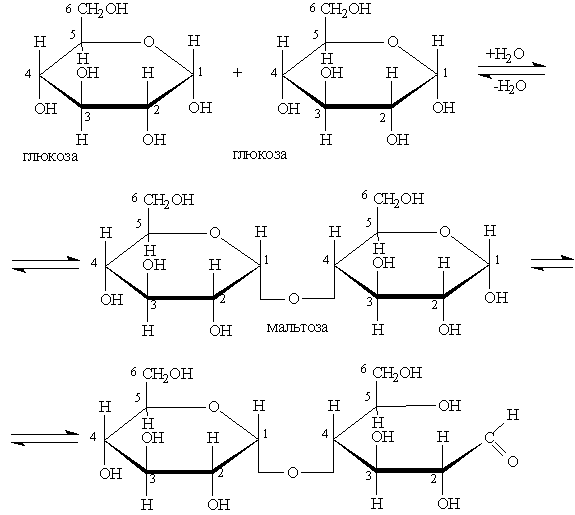
Молекула образующегося при этом дисахарида содержит один полуацетальный гидроксил и способна переходить в ациклическую альдегидную форму. Подобные дисахариды способны восстанавливать такие вещества, как Ag2O, Cu(OH)2, за что их называют восстанавливающими сахарами.
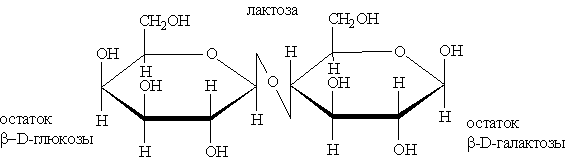
К восстанавливающим сахаром относятся также целлобиоза и лактоза:

2. Простые эфиры образуются за счет взаимодействия двух полуацетальных гидроксилов:
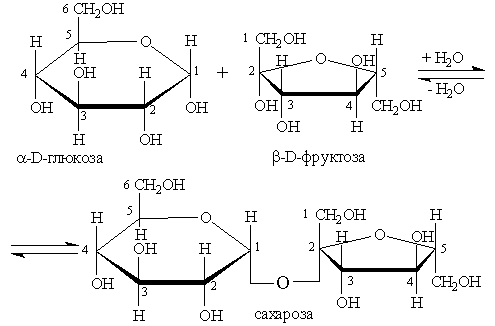
Дисахариды этого типа не дают реакцию “серебряного зеркала” и не восстанавливают гидроксид меди (II), поэтому их называют невосстанавливающими сахарами.
Дисахариды, как и моносахариды, способны образовывать простые и сложные эфиры.
Характерной особенностью дисахаридов является их способность взаимодействовать с гидроксидами металлов Са(ОН)2, Сu(ОН)2 с образованием хорошо растворимых комплексных соединений сахаратов (см. “Спирты. Фенолы”).
В кислой среде дисахариды легко гидролизуются с образованием одинаковых (мальтоза, целлобиоза) или различных (лактоза, сахароза) моносахаридов (см. выше).
Полисахариды.Общая формула полисахаридов, образованных остатками пентоз (C5H8О4)n, гексоз(C6H10О5), где n = 103 - 105. Наибольшее значение имеют производные глюкозы: крахмал и целлюлоза.
Крахмал является основным компонентом картофеля (20—24%), кукурузы (50—70%), пшеницы (» 70%), риса (» 80%).
Целлюлоза является главной составной частью древесины (» 50%), льна (» 80% ), хлопка (90—97%).
Крахмал — белый порошок, нерастворимый в холодной воде, в горячей воде набухает, образуя крахмальный клейстер. Крахмал состоит из двух фракций: амилозы(15—25%) и амилопектина(75—85%).
Амилозапредставляет собой линейный биополимер, состоящий из остатков глюкозы, соединенных через кислородные атомы в положении 1 и 4. Молекулярная масса амилозы от 150 000 до 500 000 а. е. м. в зависимости от вида растения.
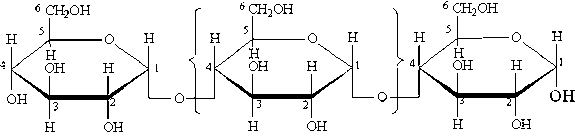
Амилопектин — это биополимер, состоящий из остатков глюкозы, соединенных через кислородные атомы в положении 1—4 и 1—6. Молекулярная масса амилопектина составляет порядка миллиона а. е. м.
Характерным признаком крахмала является его способность последовательно гидролизоваться:
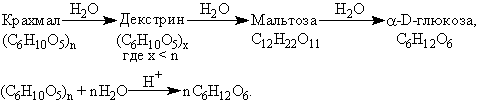
Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
Характерным свойством крахмалаявляется образование с раствором иода комплекса, имеющего синюю окраску.
Получают крахмал из природных крахмалосодержащих продуктов, чаще всего картофеля и кукурузы. Он широко используется в качестве продукта питания, а также как сырье для производства глюкозы и этилового спирта.
Целлюлоза — белый волокнистый материал, нерастворимый в воде; имеет такой же элементный состав, как и крахмал. Различие между целлюлозой и крахмалом заключается в том, что: 1) в первом случае остатки глюкозы соединены b -гликозидной связью, а во втором — a -гликозидной связью; 2) в случае целлюлозы молекула имеет линейную форму, а в случае крахмала — форму трехмерной частицы; 3) молекулярная масса целлюлозы от 106 до 109 а.е.м.
Целлюлоза способна образовывать простые (метилцеллюлоза) и сложные (нитроцеллюлоза, ацетилцеллюлоза) эфиры. Так как каждое звено молекулы целлюлозы (так же, как и крахмала) содержит три гидроксильные группы, то возможные ее сложные эфиры с азотной и уксусной кислотами можно выразить следующими формулами:
[C6H7O2(OH)2ONO2]n [C6H7O2(OH)(ONO2)2]n
мононитроцеллюлоза динитроцеллюлоза
[C6H7O2 (ONO2)3]n [C6H7O2(OH)2OСOСH3]n
тринитроцеллюлоза моноацетилцеллюлоза
[C6H7O2 (OH)( OСOСH3)2]n [C6H7O2(OСOСH3)3]
диацетилцеллюлоза триацетилцеллюлоза
Целлюлоза, подобно крахмалу, в кислой среде гидролизуется:
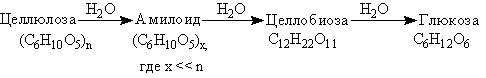
Получают целлюлозу путем “варки” (нагревание под давлением) измельченной древесины с гидросульфитом кальцияСа(НSO3)2.
Целлюлоза широко применяется для изготовления бумаги, ее ацетатные производные — для изготовления пленок (целлофан), искусственного шелка, нитропроизводные — для изготовления бездымного пороха (тринитроцеллюлоза — пироксилин).
Лекция: Азотсодержащие органические соединения
Нитросоединения. Нитросоединениями называются органические вещества, в молекулах которых содержится нитрогруппа — NO2 при атоме углерода.
Их можно рассматривать как производные углеводородов, получающиеся путем замещения атома водорода на нитрогруппу. По числу нитрогрупп различают моно-, ди- и полинитросоединения.
Названия нитросоединемий производят от названий исходных углеводородов с добавлением приставки нитро-:
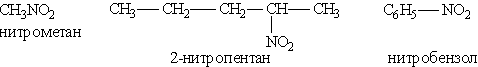
Общая формула этих соединений R—NO2.
Введение в органическое вещество нитрогруппы называется нитрованием. Его можно проводить разными способами. Нитрование ароматических соединений легко осуществимо при действии смесью концентрированных азотной и серной кислот (первая — нитрующий агент, вторая — водоотнимающий):
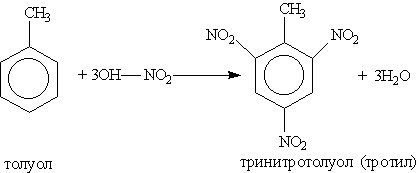
Тринитротолуол хорошо известен как взрывчатое вещество. Взрывается только от детонации. Горит коптящим пламенем без взрыва.
Нитрование предельных углеводородов проводится при действии на углеводороды разбавленной азотной кислотой при нагревании и повышенном давлении (реакция М.И. Коновалова):
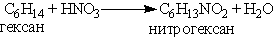
Нитросоединения часто также получают взаимодействием алкил-галогенидов с нитритом серебра:
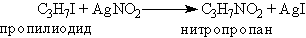
При восстановлении нитросоединений образуются амины.
Азотсодержащие гетероциклические соединения. Гетероциклические соединения — это органические соединения, содержащие в своих молекулах кольца (циклы), в образовании которых кроме атома углерода принимают участие и атомы других элементов.
Атомы других элементов, входящие в состав гетероцикла, называются гетероатомами. Наиболее часто встречаются в составе гетероциклов гетероатомы азота, кислорода, серы, хотя могут существовать гетероциклические соединения с самыми различными элементами, имеющими валентность не менее двух.
Гетероциклические соединения могут иметь в цикле 3, 4, 5, 6 и более атомов. Однако наибольшее значение имеют пяти- и шестичленные гетероциклы. Эти циклы, как и в ряду карбоциклических соединений, образуются наиболее легко и отличаются наибольшей прочностью. В гетероцикле может содержаться один, два и более гетероатомов.
Во многих гетероциклических соединениях электронное строение связей в кольце такое же, как и в ароматических соединениях. Поэтому типичные гетероциклические соединения условно обозначают не только формулами, содержащими чередующиеся двойные и одинарные связи, но и формулами, в которых сопряжение p -электронов обозначается кружком, вписанным в формулу.
Дата добавления: 2015-08-08; просмотров: 1382;
