Гальванические элементы (химические источники электрического тока)
Гальванический элемент (ГЭ) – это устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в энергию электрического тока. Теоретически для получения электрической энергии можно применить любую ОВР.
 Рассмотрим один из наиболее простых ГЭ – медно – цинковый, или элемент Даниэля – Якоби (рис. 10.1). В нём проводником соединяются пластинки из цинка и меди, при этом каждый из металлов опущен в раствор соответствующей соли: сульфата цинка и сульфата меди (II). Полуэлементы соединены электролитическим ключом1, если находятся в разных сосудах или разделены пористой перегородкой, если находятся в одном сосуде.
Рассмотрим один из наиболее простых ГЭ – медно – цинковый, или элемент Даниэля – Якоби (рис. 10.1). В нём проводником соединяются пластинки из цинка и меди, при этом каждый из металлов опущен в раствор соответствующей соли: сульфата цинка и сульфата меди (II). Полуэлементы соединены электролитическим ключом1, если находятся в разных сосудах или разделены пористой перегородкой, если находятся в одном сосуде.
Рассмотрим сначала состояние этого элемента при разомкнутой внешней цепи – режим «холостого хода». На электродах в результате процесса обмена устанавливаются следующие равновесия, которым в стандартных условиях соответствуют стандартные электродные потенциалы:
Zn2+ + 2e- D Zn 
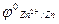 = - 0,76В
= - 0,76В
Cu2+ + 2e- D Cu 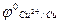 = +0,34В.
= +0,34В.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместится влево, поэтому в раствор перейдёт дополнительное количество ионов цинка (растворение цинка на цинковом электроде). В то же время равновесие на медном электроде сместится вправо и произойдёт разряд ионов меди (выделение меди на медном электроде). Данные самопроизвольные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или вся медь не осадится на медном электроде).
Итак, при работе элемента Даниэля – Якоби протекают следующие процессы:
1) движение электронов во внешней цепи от цинкового электрода к медному, т.к. 
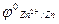 <
< 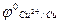 ;
;
2) реакция окисления цинка: Zn – 2e- = Zn2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами; следовательно, цинковый электрод – анод;
3) реакция восстановления ионов меди: Сu2+ + 2е = Сu.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами; следовательно, медный электрод – катод;
4) движение ионов в растворе: анионов (SO42-) к аноду, катионов (Cu2+,Zn2+) к катоду, замыкает электрическую цепь гальванического элемента;
5) cуммируя электродные реакции, получаем:
Zn + Cu2+ = Cu + Zn2+
или в молекулярном виде: Zn + CuSO4 = Cu + ZnSO4.
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи ионов внутри элемента, т.е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
При схематической записи, заменяющей рисунок гальванического элемента, границу раздела между проводником 1-го рода и проводником 2-го рода обозначают одной вертикальной чертой, а границу раздела между проводниками 2-го рода – двумя чертами. Анод – источник электронов, поступающих во внешнюю цепь – принято считать отрицательным, катод – положительным. Анод помещается в схеме слева. Схема ГЭ Даниэля – Якоби, например, записывается в виде:
(-) Zn |ZnSO4| |CuSO4| Cu (+)
или в ионно-молекулярном виде:
(-) Zn |Zn2+ ||Cu2+| Cu (+).
Причиной возникновения и протекания электрического тока в гальваническом элементе является разность окислительно-восстановитель-ных потенциалов (электродных потенциалов1) частных реакций, определяющих электродвижущую силу Еэ гальванического элемента, и в рассматриваемом случае:
 .
.
В общем случае: Еэ = jк - jа ,
где jк – потенциал катода, jа – потенциал анода.
Еэ всегда больше нуля (Еэ > О). Если реакция осуществляется в стандартных условиях, то наблюдаемая при этом ЭДС называется стандартной электродвижущей силой 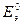 данного элемента. Для элемента Даниэля – Якоби стандартная ЭДС
данного элемента. Для элемента Даниэля – Якоби стандартная ЭДС 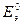 = 0,34 – (-0,76) = 1,1(В).
= 0,34 – (-0,76) = 1,1(В).
Пример.
Составьте схему, напишите уравнения электродных процессов и токообразующей реакции для гальванического элемента, образованного висмутом и железом, опущенных в растворы собственных солей с концентрацией ионов металлов в растворе CBi3+ = 0,1 моль/л, CFe2+ = 0,01 моль/л. Рассчитайте ЭДС этого элемента при 298К.
Решение.
Концентрации ионов металлов в растворе отличны от концентрации 1 моль/л, поэтому нужно рассчитать потенциалы металлов по уравнению Нернста, сравнить их и определить анод и катод.
jмеn+/ме = jомеn+/ме + 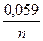 lgСмеn+;
lgСмеn+;
jBi3+/Bi = 0,21 + 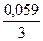 lg10-1 = 0,19В; jFе2+/Fе = -0,44 +
lg10-1 = 0,19В; jFе2+/Fе = -0,44 + 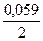 lg10-2 = - 0,499В.
lg10-2 = - 0,499В.
Железный электрод – анод, висмутовый – катод. Схема ГЭ:
(-)Fe |Fe(NO3)2||Bi(NO3)3|Bi(+)
или (-) Fe|Fe2+||Bi3+ |Bi (+).
Уравнения электродных процессов и токообразующей реакции:
 А: Fe - 2
А: Fe - 2 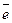 = Fe2+ 3
= Fe2+ 3
 К: Bi3+ + 3
К: Bi3+ + 3 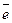 = Bi 2
= Bi 2
3 Fe + 2Bi3+ = 3Fe2+ + 2 Bi
ЭДС данного элемента Еэ = 0,19 – (-0,499) = 0,689 В.
В ряде случаев металл электрода не претерпевает изменений в ходе электродного процесса, а участвует лишь в передаче электронов от восстановленной формы вещества к его окисленной форме. Так, в гальваническом элементе
Pt |Fe2+, Fe3+|| MnO 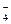 , Mn2+, H+| Pt
, Mn2+, H+| Pt
роль инертных электродов играет платина. На платиновом аноде окисляется железо (II):
Fe2+ - е- = Fe3+, 
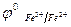
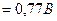 ,
,
а на платиновом катоде восстанавливается MnO  :
:
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O,  .
.
Уравнение токообразующей реакции:
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O
Стандартная ЭДС Е 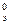 =1,51-0,77=0,74 В.
=1,51-0,77=0,74 В.
Гальванический элемент может быть составлен не только из различных, но и из одинаковых электродов, погруженных в растворы одного и того же электролита, различающиеся только концентрацией (концентрационные гальванические элементы). Например:
(-) Ag |Ag+||Ag+|Ag (+)
CAg 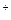 < CAg
< CAg 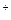
Электродные реакции: A: Ag – eˉ = Ag+;
K: Ag+ + eˉ = Ag.
Уравнение токообразующей реакции: Ag + Ag+ = Ag+ + Ag.
Свинцовый аккумулятор.Готовый к употреблению свинцовый аккумулятор состоит из решётчатых свинцовых пластин, одни из которых заполнены диоксидом свинца, а другие – металлическим губчатым свинцом. Пластины погружены в 35 – 40 % раствор H2SO4; при этой концентрации удельная электропроводность раствора серной кислоты максимальна.
При работе аккумулятора – при его разряде – в нём протекает ОВР, в ходе которой свинец (Pb) окисляется, а диоксид свинца восстанавливается:
(-) Рb|H2SO4| РbО2 (+)
А: Рb + SO  –2еˉ = РbSO4
–2еˉ = РbSO4 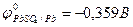
 К: РbО2 + SO
К: РbО2 + SO  + 4Н+ + 2еˉ = PbSO4 + 2H2O
+ 4Н+ + 2еˉ = PbSO4 + 2H2O 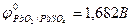
Pb + PbO2 + 4H+ + 2SO42- = 2PbSO4+ 2H2O (токообразующая реакция). 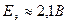 .
.
Во внутренней цепи (в растворе Н2SO4) при работе аккумулятора происходит перенос ионов: ионы SO42- движутся к аноду, а катионы Н+ - к катоду. Направление этого движения обусловлено электрическим полем, возникающим в результате протекания электродных процессов: у анода расходуются анионы, а у катода – катионы. В итоге раствор остаётся электронейтральным.
Для зарядки аккумулятора подключаются к внешнему источнику постоянного тока (“+” к “+”, “–“ к “–“). При этом ток протекает через аккумулятор в обратном направлении, обратном тому, в котором он проходил при разряде аккумулятора; в электрохимической системе осуществляется электролиз (см. р. 10.2). В результате этого электрохимические процессы на электродах «обращаются». На свинцовом электроде теперь происходит процесс восстановления (электрод становится катодом):
PbSO4 + 2eˉ = Pb + SO42-.
На электроде из PbO2 при заряде идёт процесс окисления (электрод становится анодом):
PbSO4 + 2H2O - 2eˉ = PbO2 + 4H+ + SO42-.
Суммарное уравнение:
2PbSO4 + 2H2O = Pb + PbO2 + 4H+ + 2SO42-.
Нетрудно заметить, что этот процесс противоположен тому, который протекает при работе аккумулятора: при заряде аккумулятора в нём вновь получаются вещества, необходимые для его работы.
Дата добавления: 2015-08-08; просмотров: 2045;
