Номенклатура и изомерия. Ароматическими углеводородами (аренами) называют вещества, в молекулах которых содержится одно или несколько бензольных колец – циклических групп атомов
Ароматическими углеводородами (аренами) называют вещества, в молекулах которых содержится одно или несколько бензольных колец – циклических групп атомов углерода с особым характером связей.
Рассмотрим строение молекулы бензола. Молекулярная формула бензола – СбН6. Первая структура бензола была предложена в 1865 г. немецким ученым А. Кекуле:
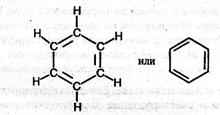
Эта формула правильно отражает равноценность шести атомов углерода, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, бензол не проявляет склонности к реакциям присоединения: он не обесцвечивает бромную воду и раствор перманганата калия, т.е. не дает типичных для непредельных соединений качественных реакций. Поэтому вопрос о строении бензола привлекал внимание исследователей на протяжении десятков лет.
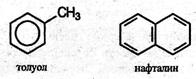
Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол), ко второму – конденсированные арены (простейший из них – нафталин):
Рассмотрим гомологический ряд бензола с общей формулой CnH.2n-6.
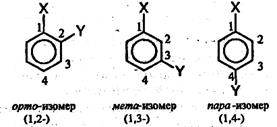
Структурная изомерия в ряду бензола обусловлена взаимным расположением заместителей в кольце. Если в бензольном кольце только один заместитель, то такое соединение не имеет ароматических изомеров, так как все атомы углерода в бензольном кольце равноценны. Если с кольцом связаны два заместителя, то они могут находиться в трех разных положениях относительно друг друга.
Положение заместителей указывают цифрами или обозначают словами:орто (о-), мета (м-), пара (n-):
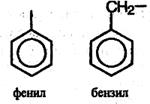
При отщеплении атома водорода от молекул ароматических углеводородов образуются ароматические радикалы общей формулы СnН2n-7 (их называют арильными радикалами), простейшие из которых – фенил и бензил:
Название ароматических углеводородов происходит от слова «бензол» с указанием заместителей в бензольном кольце и их положения, например:

Особенности строения и свойств бензола удалось полностью объяснить только после развития современной квантовомеханической теории химических связей. По современным представлениям, все шесть атомов углерода в молекуле бензола находятся в sр2-гибридном состоянии. Каждый атом углерода образует σ-связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя σ-связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник (σ-скелет молекулы бензола).
Каждый атом углерода имеет одну негибридную p-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому σ-скелету и параллельно друг другу. Все шесть р-электронов взаимодействуют между собой, образуя π-связи, не локализованные в пары, как при образовании обычных двойных связей, а образующие единое π-электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение. Наибольшая π-электронная плотность в этой сопряженной системе располагается над и под плоскостью σ-скелета.
В результате все связи между атомами углерода в бензоле выравнены и имеют длину 0,139 нм. Эта величина является промежуточной между длиной одинарной связи в алканах (0,154 нм) и длиной двойной связи в алкенах (0,133 нм). Равноценность связей принято изображать кружком внутри цикла. Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Это значение составляет энергию сопряжения – количество энергии, которое нужно затратить, чтобы разрушить ароматическую систему бензола (сравните – энергия сопряжения в бутадиене равна всего 12 кДж/моль).
Такое электронное строение объясняет все особенности бензола. В частности, понятно, почему бензол трудно вступает в реакции  присоединения – это приводит к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
присоединения – это приводит к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
Совокупность свойств бензола принято называть проявлением ароматического характера, или ароматичности. В общем виде понятие ароматичности было сформулировано немецким физиком Э. Хюккелем в виде так называемого правила Хюккеля.
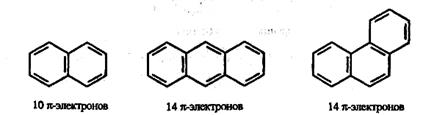
Согласно этому правилу, ароматические молекулы должны иметь плоский циклический σ-скелет и число обобщенных π-электронов, равное 4n + 2, где n= 1, 2, 3 и т.д. Только в этом случае молекула будет обладать ароматическим характером. Число обобщенных π-электронов может быть 6, 10, 14 и т.д. Примерами служат выделяемые из каменноугольной смолы полиядерные конденсированные ароматические углеводороды – нафталин, антрацен, фенантрен. В них бензольные кольца соединены друг с другом линейно (как в антрацене) или нелинейно (как в фенантрене):
Дата добавления: 2015-08-08; просмотров: 869;
