Упругость насыщенных газов
Упругость насыщенных паров углеводородов характеризует то давление, при котором газ начинает конденсироваться и переходить в жидкое состояние. У индивидуальных углеводородов в чистом виде упругость паров (Q) есть функция только температуры: Q =ƒ (Т). Величина упругости насыщенных паров углеводородов повышается с ростом температуры, и она тем выше, чем ниже плотность углеводорода. Аналогично с ростом молекулярной массы углеводорода, величина упругости насыщенный паров углеводородов уменьшается при равных температурах (рис. 2.11).
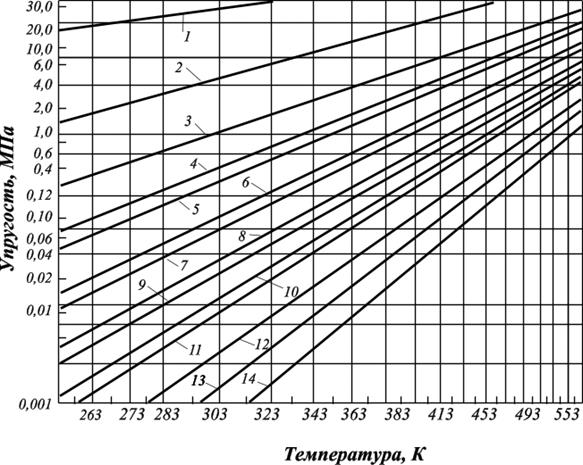
Рис. 2.11. Кривые упругости насыщенных паров чистых углеводородов:
1. – метан; 2. – этан; 3. – пропан; 4. – изобутан; 5. – бутан; 6. – изопентан; 7. – пентан; 8. – изогексан; 9. – гексан; 10. – изогептан; 11. – гептан; 12. – октан; 13. – нонан; 14. – декан
Зависимость упругости пара от температуры: Q =ƒ (Т) – нелинейная функция. Для ее линеаризации шкала упругости пара принята логарифмической, и это создает удобства для пересчета величины упругости пара при нужной температуре. Анализ зависимостей представленных на рис. 2.11 свидетельствует, что давление паров метана наибольшее. При нормальных условиях его нельзя превратить в жидкость (пунктирная линия), так как его критическая температура (Ткр.) = – 82,4о С (190,75 К).
На рис. 2.12, а изображены зависимости объёма жидкого и парообразного пропана. При сжатии от точки М до точки А имеется перегретый (ненасыщенный) пар, зависимость объёма жидкости от давления при конкретной температуре имеет гиперболическую форму.
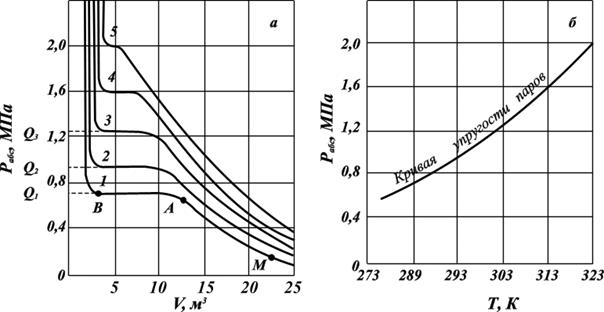
Рис. 2.10. Зависимости давления от объёма и температуры (а) и кривая упругости насыщенных паров (б) при температурах, К: 1. – 283; 2. – 293; 3. – 303; 4. – 313; 5. – 323.
В точке А пар становится насыщенным, а при дальнейшем изменении объёма (участок АВ) он постепенно переходит в жидкость при неизменном давлении. В точке В заканчивается переход пара в жидкость. При дальнейшем сжатии пара будет резко повышаться давление при почти неизменном объёме. Горизонтальный участок АВ соответствует неизменности давления в процессе конденсации паровой фазы в жидкую фазу. Величина этого давления и есть упругость насыщенного пара газового компонента при данной температуре. Чем ближе значение температуры, при которой измеряется упругость насыщенного пара газового компонента к значению критической температуре, тем короче горизонтальный участок. На основе полученных данных строят кривую упругости насыщенных паров, представляющую зависимость давления от от температуры испарения данной жидкости (рис. 2. 12, б).
У смеси углеводородов упругость паров является функцией и температуры и общего давления смеси: Q = ƒ (Т, Рсм.). Величина её зависит от упругости паров отдельных компонентов при данной температуре и от их мольных концентраций. Общее давление смеси влияет на упругость паров каждого компонента и это влияние учитывается по закону Рауля:
Р = ∑ рi и 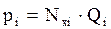 (2.39)
(2.39)
где Р – общее давление;
рi – парциальное давление i-го компонента;
Qi – упругость паров i-го компонента;
Nxi – мольная доля i-го компонента в жидкости.
Упругость паров смеси компонентов повышается с увеличением общего давления. Это влияние ничтожно при низких давлениях (≈ до 1 МПа), а при высоких давлениях упругость паров резко увеличивается.
Дата добавления: 2015-08-08; просмотров: 1067;
