Представления о корпускулярно-волновом дуализме электрона
Движение электронов в атомах Н. Бор представлял как простое механическое, однако оно является сложным и своеобразным. Это своеобразие было объяснено новой квантовой теорией. Отсюда и пошло: «Карпускулярно-вролновой дуализм».
В 1924г. было установлено, что свет представляет собой волны и частицы – фотоны:
Электрон - частица: имеет массу, оказывает физическое воздействие ( вертушка), имеет скорость.
Электрон - волна: имеет фазу, можно определить длину волны, пучок электронов испытывает дифракцию, интерференцию.
В 1924 г. Луи де Бройль предположил, что электроны, подобно фотонам, распространяются волнами. Для фотонов Эйнштейн предложил уравнение, связывающее массу и энергию:
E = mc2 . (3.4)
при этом известно, что энергия фотона определяется через его частоту:
E = hn . (3.5)
Подставив в (1) скорость движения электрона и приравняв (1) и (2), Луи де Бройль получил следующее:
mv2 = hn = hv/l, (3.6)
где l - длина волны электрона.
Тогда можно получить фундаментальное соотношение между корпускулярными и волновыми свойствами частиц:
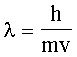 . (3.7)
. (3.7)
Волны, возникающие при движении материальных частиц, получили название волн де Бройля. Почему это соотношение важно для микрочастиц, но не существенно для макрообъектов? Постоянная Планка h=6.626*10-34Дж*с. Если рассмотреть объект, массой 1 г, движущийся со скоростью 1см/с, то подставив в (3), мы получим длину волны l=6*10-28см. А вот если рассмотреть электрон, скорость которого в электрическом поле с DЕ = 100 В равна 6*106м/с, то получим l=0.12 нм, т. е. величину, вполне соизмеримую с размерами атома.
Принцип неопределенности Гейзенберга
Все вышесказанное свидетельствует о том, что электрон ”размазан” в атоме. Как это можно себе представить? Ответ на вопрос дает принцип неопределенности Гейзенберга. Основная идея - невозможно в любой данный момент времени определить и положение в пространстве и импульс (p=mv) электрона. Математически это выражается так:
(Dp)(Dx)³h/m , (3.8)
где Dp - неопределенность в величине импульса,
Dx - неопределенность в положении частицы в пространстве.
Таким образом, чем точнее удается измерить импульс электрона, тем менее точно мы сможем установить его положение в пространстве. Мы должны принять, что электрон представляет собой одновременно и частицу и волну.
Дата добавления: 2015-08-08; просмотров: 893;
