Расчет абсолютной энтропии
Рассчитаем изменение энтропии некоторой системы при нагревании её от абсолютного нуля до температуры T при постоянном давлении. Из первого и второго начал термодинамики имеем:
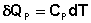 (I.61)
(I.61)
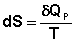 (I.62)
(I.62)
Отсюда:
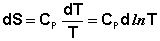 (I.63)
(I.63)
Учитывая, что ST=0 = 0, получим:
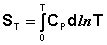 (I.64)
(I.64)
При T = 0 любое вещество может находиться только в твердом состоянии. При нагревании вещества возможен его переход в жидкое и затем в газообразное состояние; для фазовых переходов, происходящих в изобарно-изотермических условиях, изменение энтропии равно приведенной теплоте фазового перехода:
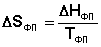 (I.65)
(I.65)
Таким образом, нагревание вещества без фазовых переходов сопровождается непрерывным ростом энтропии; при фазовом переходе происходит скачкообразное изменение энтропии. Графическая зависимость энтропии вещества от температуры приведена на рисунке 1.3.
Учитывая это, рассчитать абсолютную энтропию любого вещества при любой температуре можно следующим образом:
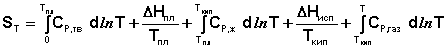 (I.66)
(I.66)
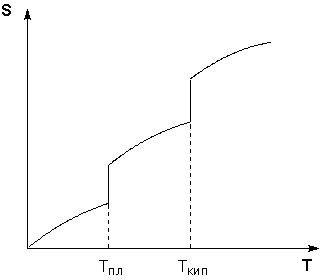
Рис. 1.3Зависимость энтропии вещества от температуры.
Поскольку энтропия есть функция состояния, изменение энтропии в ходе химического процесса определяется только видом и состоянием исходных веществ и продуктов реакции и не зависит от пути реакции; оно может быть рассчитано по уравнению (I.67):
 (I.67)
(I.67)
Для многих веществ величины абсолютной энтропии в стандартных условиях приведены в справочной литературе.
Дата добавления: 2015-08-08; просмотров: 723;
