Основные закономерности химии d-элементов
Электронная структура. Атомы большинства d-элементов имеют на внешнем слое по два s-электрона и на предвнешнем слое – от одного до десяти электронов [(n-1)d1-10ns2]. Исключение составляют атомы первой группы [(n-1)d10ns2] некоторые атомы VI группы (Cr – 3d54s1, Мо – 4d55s1) и VIII группы (Ru—4d75s1, Rh – 4d85s1, Pt – 5d96s1), у которых на внешнем уровне имеется лишь по s-электрону, (происходит "провал" одного s-электрона на d-подуровень). У палладия внешний s-подуровень не заполнен (Рd – 4d105s0). В периодической системе d-элементы находятся в середине периода между s- и p-элементами и называются переходными металлами. Формирующими у них являются d-электроны.
 Разность между энергиями ns-, np- и (n-1) d-электронами невелика, поэтому при образовании простых веществ (металлов) вместо ns-и np- и частично (n-1) d-уровней возникают зоны проводимости, в которых размещаются нелокализованные (обобществленные) электроны. Образование зон проводимости, неполностью заполненных нелокализованными электронами, обусловливает металлическое состояние этих веществ. Число нелокализованных электронов в зоне проводимости у различных элементов колеблется в небольших пределах (от 1,5 до 2,5 на атом), d-металлы кристаллизуются, как правило, в кубической или гексагональной решетках. Наличие обобществленных электронов обусловливает металлические свойства d-элементов: электрическую проводимость, теплопроводность, металлический блеск и ковкость.
Разность между энергиями ns-, np- и (n-1) d-электронами невелика, поэтому при образовании простых веществ (металлов) вместо ns-и np- и частично (n-1) d-уровней возникают зоны проводимости, в которых размещаются нелокализованные (обобществленные) электроны. Образование зон проводимости, неполностью заполненных нелокализованными электронами, обусловливает металлическое состояние этих веществ. Число нелокализованных электронов в зоне проводимости у различных элементов колеблется в небольших пределах (от 1,5 до 2,5 на атом), d-металлы кристаллизуются, как правило, в кубической или гексагональной решетках. Наличие обобществленных электронов обусловливает металлические свойства d-элементов: электрическую проводимость, теплопроводность, металлический блеск и ковкость.
|
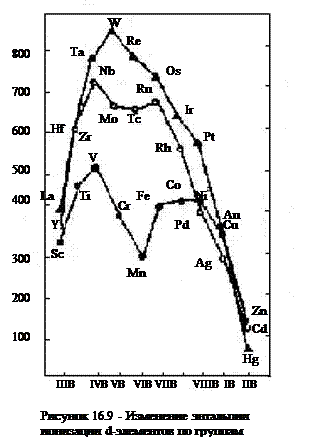
Физические свойства. На физические свойства простых веществ заметно влияет число неспаренных d-электронов в предвнешнем слое, которые могут образовать локализованную связь. Максимальную температуру плавления имеют элементы V — VI групп, обладающие по 3-4 неспаренным d-электронам. Эти же элементы — характеризуются максимальной энтальпией атомизации (энергией превращения металла в газообразное состояние, рисунок 16.9).
Заметное снижение температуры плавления и энергии атомизации, наблюдаемое у марганца и технеция, обусловлено особенностями электронной структуры этих металлов (завершением заполнения атомных орбиталей d-подуровня по одному электрону). Металлы, имеющие на внешнем s-подуровне один электрон, как правило имеют более высокую электрическую проводимость (Сг, Мо и особенно Сu, Ag, Au). Элементы III группы, имеющие всего один d-электрон, по своим свойствам близки к соседним щелочно-земельным металлам, а d-элементы II группы с полностью заполненным d-подуровнем близки по свойствам к своим соседним p-элементам (подгруппы галлия).
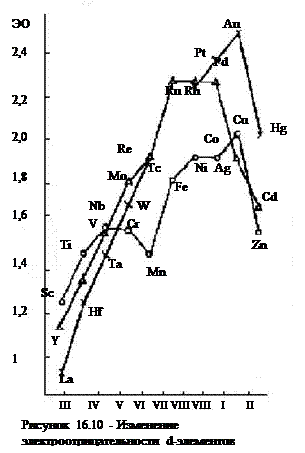
Химические свойства.Все являютсявосстановителями. Кривые зависимости электроотрицательности (рисунок 16.10) от номера группы стандартных электронных потенциалов от порядкового номера элемент периоде проходят через максимум у металлов VШ-I групп. Наиболее сильными восстановителями являются элементы III группы также цинк и кадмий (II группа). Соответственно для всех d-элементов, кроме платиновых металлов и металлов I группы, термодинамически вероятна коррозия с выделением водорода в растворах кислот. Однако у большинства d-элементов образуются защитные оксидные пленки, вызывающие их пассивацию и предохраняющие от коррозии. Наиболее склонны к пассивации металлы IV – VI групп. Элементы III и II групп (кроме ртути) легко взаимодействуют с разбавленными кислотами, а некоторые, например лантан, и с водой.
Общим свойством соединений почти всех d-элементов является степень окисления. Так как на внешнем слое у большинства d-элементов находятся два s-электрона, то они проявляют степень окисления +2. Высшая степень окисления у элементов, не содержащих на орбиталях пар d-электронов (III - VII группы), соответствует номеру группы. Для элементов VIII группы, у которых d-орбитали имеют электронные пары, высшие степени окисления не характерны. Исключение составляют рутении и осмии, проявляющие высшие степени окисления +8. В связи с переменными степенями окисления для большинства d-элементов характерны окислительно-восстановительные реакции. Строение и свойства соединений d-элементов зависят от степени окисления атомов. Соединения металлов низшей степени окисления (обычно +2, иногда +1) с сильными делителями имеют, как правило, ионный характер. Соединения многих d-элементов со слабыми окислителями (N, В, С, Н, S, Si) являются металлоподобными веществами. Они обладают электрической проводимостью, некоторые из них (NbxNy, NbxCy и другие) и сверхпроводимостью при низких температурах. Большинство соединений с низшей степенью окисления металлов — восстановители. В соединениях высшей степени окисления металлов химические связи относят к полярно-ковалентным. Например, в молекуле ТiСl4 хлор образует ковалентные связи с четырьмя гибридизованными (d2sp)-орбиталями титана. При обычных условиях ТiСl4 — жидкость. Соединения d-элементов высшей степени окисления — сильные окислители (KMnO4, К2СгО4 и др.). С увеличением степени окисления атомов в оксидах и гидроксидах усиливается кислотный характер последних:
 Усиление основных свойств
Усиление основных свойств
| MnO | Мn2О3 | МnO2 | МnO3 | Mn2O7 |
| Мn(ОН)3 | Мn(ОН)4 | Н2МnО4 | Мn2O7 | НМnО4 |
 |
Усиление кислотных свойств
Оксид марганца МnО является основным, гидроксид Мn(ОН)4 - амфотерным соединением, а НМnО4 — очень сильная кислота.
Так как атомы d-элементов и их ионы имеют большое число вакантных орбиталей внешнего (p- и s-орбитали) и предвнешнего слоев (d- и у многих f-орбиталей) и относительно небольшой радиус, то для них характерна склонность к комплексообразованию. Они могут образовывать комплексы нейтрального, например Mn(CO)5, катионного, например [Сd(NН3)4]2+, и анионного, например [Fe(CN)6]3- , характера. Прочность комплексов с одинаковыми лигандами возрастает с увеличением заряда иона металла и уменьшением его радиуса, в одном и том же периоде при перемещении вправо от VI до I группы.
Вопросы для самоконтроля
1. Какие аллотропные модификации олова вы знаете и какими буквами следует их обозначать?
2. Напишите уравнения реакций оксидов NO2 и SrO, на основании которых можно судить о металлических и неметаллических свойствах элементов.
3. Приведите примеры соединений постоянного и переменного состава. К какому типу относятся лед и сульфид свинца?
4. Почему s-металлы имеют низкие значения плотностей и температур плавления?
5. Почему при опускании стальных образцов в раствор, содержащий ионы меди, на образцах осаждается медь?
6. Какие металлы могут и какие не могут вытеснять ионы водорода из раствора с рН 0?
7. Возможно ли самопроизвольное окисление меди и висмута ионами водорода и бромом при рН 0 и рН7?
8. Какое число лигандов могут координировать ионы Zn2+ и Pt4+.
9. Можете ли объяснить причину нахождения некоторых металлов в природе в свободном состоянии?
10. Можете ли предложить способы значительного сокращения расхода металлов, кроме перечисленных в данном разделе?
11. Напишите реакцию получения молибдена восстановлением его оксидов и хлоридов водородом.
12. Напишите реакцию восстановления Сг2Оз алюминием и ТiСl4 магнием.
13. Если в руде массовая доля халькопирита (СuFеS2) составляет 20%, то сколько теоретически можно получить меди и железа из тонны руды?
14. Какие примеси перейдут в раствор, а какие в анодный шлам при электрохимическом рафинировании меди, содержащей марганец, цинк и золото?
15. В каком случае больше разница между свойствами металла и сплава: а)твердого раствора; б) интерметаллида?
16. Уменьшиться или увеличится температура плавления вещества при образовании сплава: а)эвтектики; б) интеметаллида?
17. Кермет, состоящий из оксида алюминия и никеля, можно изготовить химическим восстановлением никеля из солей на матрицу А12Оз. Напишите реакцию восстановления карбоната никеля водородом при повышенной температуре.
18. Какие из металлов являются более сильными восстановителями: Li или Mg?
19. Напишите реакции взаимодействия калия и кальция с водой и кислородом.
20. Напишите реакции взаимодействия натрия с Н2О, Н2S04 и НNО3. Опасны ли эти реакции и почему?
21. Напишите реакцию получения магния из его хлорида с помощью натрия.
22. Напишите электронную структуру иона бериллия. Какое координационное число структур будет иметь комплекс бериллия и гидроксид-ионов? Напишите образования комплексного соединения при взаимодействии ВеС12 и NaОН.
23. Алюминий применяется для получения некоторых металлов путем восстания их оксидов (алюмотермия), например по реакции
WO3 + 2А1 = W + Аl2O3
24. Приведите примеры большой склонности d-элементов к образованию комплексных ионов. Приведите примеры комплексных катионов и анионов, определите координационные числа и заряды комплексообразователей.
25. Объясните, почему d-элементы характеризуются переменными степенями окисления.
Дата добавления: 2015-08-08; просмотров: 4293;
