Элементы квантовой теории строения материи.
То, что атом является первокирпичиком материи, догадывались еще мудрецы древности. Именно свойства атомов определяют свойства веществ. Однако, как устроен атом, начало проясняться постепенно, начиная с конца 19 века. Долгое время считалось, что плотность распределения энергии излучения тел по длинам волн представляет непрерывную функцию. И аналитические выражения, описываемые формулами Рэлея-Джинса, вроде бы это подтверждали. Однако при проведении экспериментов с определением энергии излучения абсолютно черного тела выяснилось, что эти формулы удовлетворительно согласуются лишь при достаточно больших длинах волн и резко расходятся с опытом для малых длин волн, хотя с классической точки зрения формулы были безупречны.
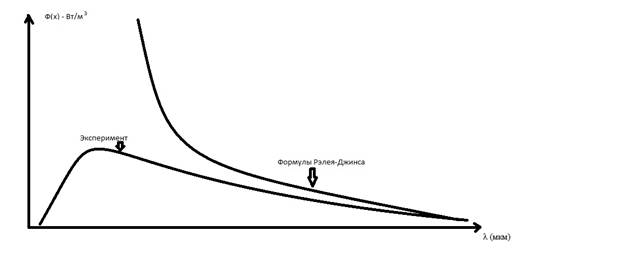
Это расхождение (результат) получило название ультрафиолетовой катастрофы, что указывало на существование закономерностей, несовместимых с представлениями классической физики.
В 1900 году Планку удалось найти вид функции, в точности соответствующей опытным данным. Для этого ему необходимо было сделать предположение, не укладывающееся в рамки классических представлений. Он выдвинул гипотезу, в соответствии с которой электромагнитное излучение испускается в виде отдельных порций энергии, величина которых пропорциональна частоте излучения.
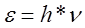
Эти порции энергии получили название квантов, а коэффициент пропорциональности h был впоследствии назван постоянной Планка (h=6,62* 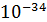 Дж*с).
Дж*с).
Если излучение испускается порциями, то его энергия должна быть кратна этой величине:
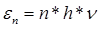 , где n=0, 1, 2, …
, где n=0, 1, 2, …
Проводя опыты по рассеянию α-частиц, Резерфорд в 1911 году предложил ядерную модель атома. Согласно этой модели атом представляет собой систему зарядов, в центре которой расположено тяжелое положительное ядро с зарядом Z*e, имеющее размеры не более 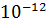 см, а вокруг ядра расположены Z электронов, распределенных по всему объему атома. Атом электронейтрален.
см, а вокруг ядра расположены Z электронов, распределенных по всему объему атома. Атом электронейтрален.
Однако ядерная модель атома оказалась в противоречии с законами классической механики и электродинамики. Поскольку система неподвижных зарядов не может находиться в устойчивом состоянии, Резерфорду пришлось отказаться от статической модели атома и предположить, что электроны движутся вокруг ядра по орбитам. Но в этом случае электроны будут двигаться с ускорением и согласно классической электродинамике должны непрерывно излучать электромагнитные волны и терять энергию, что должно привести к нарушению равновесия центробежных и центростремительных сил и падению электронов на ядро.
Однако этого не происходит, что подтверждается наличием атомных оптических спектров, имеющих линейчатую структуру, которым соответствуют определенные дискретные значения частот.
Выяснилось, что классическая механика и электродинамика неспособны объяснить ни устойчивость атома, ни характер атомного спектра.
Выход из тупика был предложен в 1913 году датским физиком Нильсом Бором, ценой введения предположений, противоречащих классическим представлениям. Допущения Бора представляют два его постулата.
Постулаты Бора.
1. Из бесконечного множества электронных орбит, которые возможны с точки зрения классической механики, осуществляются в действительности, только некоторые дискретные (стационарные) орбиты, удовлетворяющие определенным квантовым условиям. На таких орбитах электроны не излучают электромагнитной энергии, несмотря на движение с ускорением. Для этого необходимо, чтобы момент импульса электрона был равен целому кратному постоянной Планка.

(n=1, 2, 3, …)
2. Возможность излучения или поглощения кванта энергии появляется у электрона только при переходе из одного стационарного (устойчивого) состояния в другое, поэтому
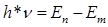 - разность энергий стационарных уровней, между которыми совершается квантовый скачок.
- разность энергий стационарных уровней, между которыми совершается квантовый скачок.
Несмотря на блестящее экспериментальное подтверждение постулатов Бора, его теория не была последовательно квантовой теорией и не учитывала волновых свойств вещества.
В 1924 году Луи де-Бройль выдвинул смелую гипотезу, что корпускулярно-волновые свойства (дуализм) присущи не только оптическим явлениям, но и движущимся частицам вещества. Поэтому электрон обладает как свойствами частицы, так и волновыми свойствами: при движении по замкнутой орбите электрон не излучает электромагнитной энергии, если вдоль орбиты укладывается целое число длин волн (стоячая волна).

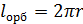 ;
; 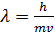 ;
; 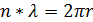 , n - целое
, n - целое
Принцип Паули. В соответствии с этим принципом распределение электронов по энергетическим уровням происходит так, что электроны стремятся занять уровни с наименьшей энергией, поэтому все внутренние орбиты оказываются полностью заполненными. Частично может быть заполнена только внешняя орбита (которая определяет оптические и химические свойства атома).
Принцип запрета Паули гласит, что на каждом энергетическом уровне может находиться не более 2-х электронов (с различными спинами).
Дата добавления: 2015-08-04; просмотров: 1152;
