Толстый миофиламент. 2.Молекулы миозина. 3.Головки миозина. 4.Тонкий миофиламент. 5.Молекулы актина. 6.Тропомиозин. 7.Тропониновый комплекс.
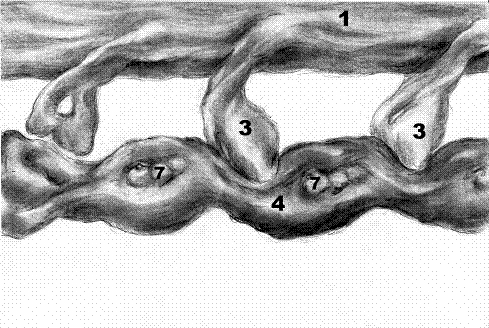 Сократительный аппарат мышечного волокна представлен миофибриллами – специальными органеллами, имеющими вид нитей диаметром 1-2 мкм. Они располагаются продольно на всю длину миосимпласта. Миофибриллы состоят из тонких (4) актиновых (диаметр 5 нм) и толстых (1) миозиновых (диаметр 12 нм) филаментов. В состав актиновых филаментов входит белок актин (5), а также белки тропонин и тропомиозин. В отличие от обычных актиновых нитей тонкие миофиламенты не подвергаются постоянному распаду и полимеризации. Это обьясняется присоединением к их актиновым цепочкам стабилизирующего белка - тропомиозина. Молекулы актина (5) имеют глобулярное строение и, соединяясь вместе, образуют длинные цепи. В актиновых филаментах таких цепей две, они образуют двойную спираль. В бороздках между цепями актина лежат молекулы тропомиозина (6). К молекулам тропомиозина на равных расстояниях друг от друга прикрепляются молекулы тропонина. Тропониновый комплекс (7) состоит из трех глобулярных субъединиц: тропонин T, тропонин C и тропонин I. Тропонин T осуществляет прикрепление тропонинового комплекса к тропомиозину. Тропонин C связывается с ионами кальция. Тропонин I препятствует взаимодействию миозиновых головок с актином. В покое молекулы актина связаны с тропомиозином и тропонинами таким образом, что актин блокирован и не может взаимодействовать с миозином.
Сократительный аппарат мышечного волокна представлен миофибриллами – специальными органеллами, имеющими вид нитей диаметром 1-2 мкм. Они располагаются продольно на всю длину миосимпласта. Миофибриллы состоят из тонких (4) актиновых (диаметр 5 нм) и толстых (1) миозиновых (диаметр 12 нм) филаментов. В состав актиновых филаментов входит белок актин (5), а также белки тропонин и тропомиозин. В отличие от обычных актиновых нитей тонкие миофиламенты не подвергаются постоянному распаду и полимеризации. Это обьясняется присоединением к их актиновым цепочкам стабилизирующего белка - тропомиозина. Молекулы актина (5) имеют глобулярное строение и, соединяясь вместе, образуют длинные цепи. В актиновых филаментах таких цепей две, они образуют двойную спираль. В бороздках между цепями актина лежат молекулы тропомиозина (6). К молекулам тропомиозина на равных расстояниях друг от друга прикрепляются молекулы тропонина. Тропониновый комплекс (7) состоит из трех глобулярных субъединиц: тропонин T, тропонин C и тропонин I. Тропонин T осуществляет прикрепление тропонинового комплекса к тропомиозину. Тропонин C связывается с ионами кальция. Тропонин I препятствует взаимодействию миозиновых головок с актином. В покое молекулы актина связаны с тропомиозином и тропонинами таким образом, что актин блокирован и не может взаимодействовать с миозином.
Толстые филаменты образованы упорядочено упакованными молекулами фибриллярного белка миозина. Каждая молекула миозина состоит из двух частей: головки и хвоста и может изменять пространственную ориентацию за счет шарнирных участков. Головки миозина проявляют ферментативную активность и способны расщеплять АТФ энергия которой идет на сокращение. Хвостовыми частями молекулы миозина соединяются в пучки и формируют толстый миофиламент (1). Головки миозина (3) расположены снаружи.
В покое при низкой концентрации ионов Са2+ миозиновые головки не могут взаимодействовать с участками связывания на молекуле актина, потому что они прикрыты тропонин-тропомиозиновым комплексом. При возбуждении повышается концентрации ионов Са2+ в области миофиламентов. Взаимодействие актиновых и миозиновых филаментов при сокращении запускается ионами Са2+. Субъединица тропонина C тонкого миофиламента, связываясь с Са2+, к которому имеет высокую степень сродства, подвергается пространственному изменению. Это меняет форму тропонинового комплекса; происходит перестройка пространственной конфигурации тропомиозина и изменяется форма актиновой нити. Молекулы актина могут взаимодействовать с головками миозина. Миозиновые головки соединяются с ближайшими молекулами актина (с их миозинсвязывающими участками). При этом происходит сокращение миозинов в зонах шарнирных участков и толстая нить продвигается вперед в направлении центральной части изотропного диска. Следующим этапом является разрушение АТФ легкими цепями меромиозина (они присоединены к миозиновым головкам). При этом «разрывается» связь миозина с актином. Шарнирный участок «выпрямляется», т.е. принимает исходное положение. Но миозиновые головки располагающиеся впереди вновь связываются с последующими молекулами актина – и вновь движение вперед. Миозиновые головки «шагают» по актину.
Расслабление после мышечного сокращения происходит в результате снижения концентрации Са2+, тропонин С высвобождается, актиновый филамент восстанавливает свою структуру. Миозинсвязывающие участки актина «закрываются» и взаимодействие актина и миозина невозможно. Миофибриллы занимают исходное положение и происходит расслабление мышечного волокна
Фрагмент какой ткани на схеме? Аргументируйте выводы. Назовите структуры, обозначенные цифрами, буквами?
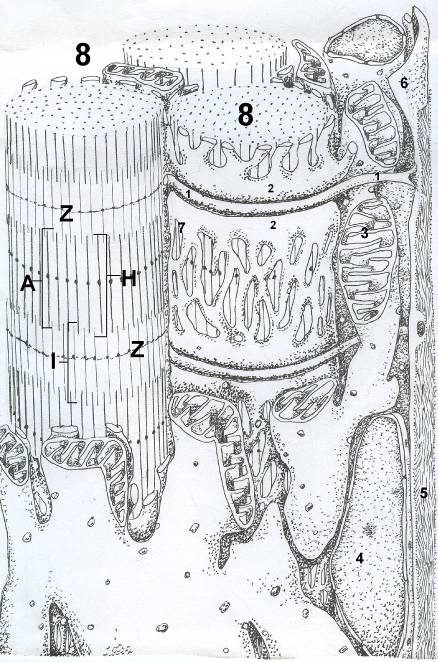 Рис. 27. Фрагмент мышечного волокна скелетной мышечной ткани.
Рис. 27. Фрагмент мышечного волокна скелетной мышечной ткани.
1.Т-трубочка. 2.Терминальная цистерна саркоплазматической сети; А - Анизотропный диск; I – Изотропный диск; Z – линия Z; Н - Полоска H. 3.Митохондрии. 4.Ядро. 5.Базальная мембрана. 6.Плазмолемма. 7.Агранулярная ЭПС. 8.Миофибриллы.
Структурно – функциональная единица скелетной мышцы – мышечное волокно. Это симпласт и миосателитоциты. Мышечное волокно имеет форму цилиндра с заостренными концами. Оболочка волокна (сарколемма) состоит из плазмолеммы симпласта и базальной мембраны. Между базальной мембраной и плазмолеммой расположены овальной формы ядра клеток – сателлитов. Ядра мышечного волокна (4) лежат под плазмолеммой в саркоплазме. В саркоплазме симпласта расположены: сократительный аппарат - миофибриллы (8); саркоплазматическая сеть (депо кальция) (7); энергетические станции – митохондрии (3); включения (гранулы гликогена). От поверхности мышечного волокна к расширенным участкам саркоплазматического ретикулума направляются трубковидные выпячивания плазмолеммы – поперечные трубочки (Т-трубочки) (1).
Сократительный аппарат – миофбриллы придают мышечному волокну поперечную исчерченность, обусловленную регулярным чередованием в миофибриллах светлых и темных участков (дисков) изотропных (I) и анизотропных (А): светлых и темных. Разное светопреломление дисков обусловлено тем, что по длине саркомера упорядочено, расположены тонкие и толстые нити. Каждый светлый диск пересекает Z-линия. Участок миофибриллы между двумя Z-линиями определяется как саркомер – структурно–функциональная единица миофибриллы. Саркомер образуют расположенные параллельно друг другу тонкие (актиновые) и толстые (миозиновые) нити. Изотропный диск содержит только тонкие нити. Один конец тонкой нити прикрепляется к Z-линии, а другой конец направлен к середине саркомера. Толстые нити занимают центральную часть саркомера (А-диск). Тонкие нити частично входят между толстыми. Содержащий только толстые нити участок саркомера Н-зона, в середине её проходит М-линия. Саркомер содержит один А-диск (темный) и две половины изотропного диска (светлого). Формула саркомера: Z1 + 1/2 I1 + А + 1/2 I2 + Z2. Миозин – гексамер (две тяжелые цепи и четыре легкие). Тяжелые цепи – две спирально закрученные полипептидные нити, несущие на своих концах глобулярные головки. В области головок с тяжелыми цепями ассоциированы легкие цепи. Тонкая нить состоит из актина, тропомиозина и тропонинов. Тонкая нить - это две спирально скрученные цепочки F-актина. Полярные молекулы тропомиозина укладываются конец в конец в желобке между двумя спирально закрученными цепочками F-актина. Тропонин препятствует взаимодействию актина с миозином.
При поступлении нервного импульса волна деполяризации доходит до цистерн саркоплазматического ретикулума, из них выделяются ионы кальция и концентрация кальция в саркоплазме резко возрастает. Кальций диффундирует к тонким нитям саркомера, где связывается с тропонином и миозиновыми головками. Происходит взаимодействие миозиновых головок с актином (актомиозиновые «мостики»). Это приводит к тому, что миозиновые головки «шагают по актину», образуя в ходе перемещения новые связи актина и миозина, сближая две Z-линии. Уменьшаются светлые диски. При расслаблении концентрация Са 2+ в саркоплазме становится низкой – Са 2+ - тропомиозин закрывает миозинсвязывающие участки тонких нитей и препятствует их взаимодействию с миозином.
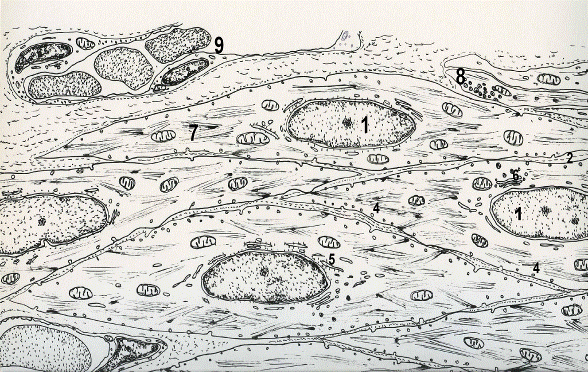
Клетки какой ткани изображены на рисунке? Назовите структуры обозначенные цифрами.
Рис. 28. Гладкий миоцит.
Дата добавления: 2015-08-01; просмотров: 2914;
