Эффекты сопряжения.
Осуществление влияния природы атомов на распределение электронной плотности в молекуле возможно как по системе σ-связей посредством индуктивного эффекта, так и по системе π-связей. Способность π-электронов к смещению особенно ярко выражена в соединениях, в которых существует система чередующихся кратных и простых связей:
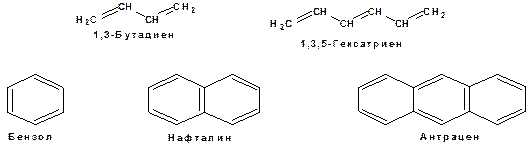
Такие соединения построены только из атомов в состоянии sp2-гибридизации. А сами такие системы называются сопряженными. Физической основой сопряжения является взаимодействие (перекрывание) р-орбиталей соседних двойных связей:
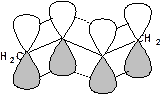
Сопряженная система представляет собой сплошную π-связь только электронная плотность концентрированна в большей степени на двойной связи и в меньшей степени на простой связи. Т.е. в случае сопряженной системы отсутствуют разрывы в цепочке связей как в случае σ-остова. Соответственно в случае появления в сопряженной системе атома, электроотрицательность которого отличается от электроотрицательности атома углерода в состоянии sp2-гибридизации, то в зависимости от того донором или акцептором является функциональная группа – произойдет смещение электронной плотности по всей цепи сопряжения. Эффект смещения электронной плотности по цепи сопряжения называется мезомерным эффектом (обозначается буквой «М»). В зависимости от направления смещения электронной плотности от заместителя или к нему различают положительный мезомерный эффект (+М) и отрицательный мезомерный эффект (-М). Графически мезомерные эффекты обозначается изогнутой стрелкой Часто термин «мезомерный эффект» заменяют термином «эффект сопряжения». Но сопряжение обозначает перекрывание орбиталей соседних связей, а мезомерия обозначает передачу влияния по цепи сопряженных связей:

Комбинация изогнутых стрелок по структурной формуле отражает перераспределение электронной плотности в цепи сопряжения. Данное перераспределение называется делокализацией «размазыванием». Иногда делокализацию изображают графически пунктирной линией по структурной формуле:
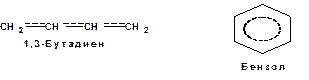
Такие формулы называют мезомерными формулами. Делокализация оказывает большое влияние на свойства сопряженных молекул. Чем выше степень делокализации тем выше термодинамическая стабильность сопряженной системы. Обратите внимание на порядок в своих комнатах. Чаще бывает беспорядок. Т.е. беспорядок более устойчивое состояние. Делокализация - то беспорядок в распределении электронов. Частным случаем делокализации является сверхсопряжение, которое способствует стабилизации неспаренных электронов алкильных радикалов.
Эффекты сопряжения характерны для соединений с кратными связями (двойные, тройные) независимо от природы атомов, соединенных кратными связями, а также для функциональных групп в состав которых входят гетероатомы с неподеленными электронными парами.
Дата добавления: 2015-08-01; просмотров: 958;
