Коррозионный гальванический элемент
В большинстве практических случаев поверхность металла неоднородна (гетерогенна) по структуре, химическому составу, свойствам защитных пленок, величине внутренних напряжений. Кроме того, раствор электролита может быть неоднородным по концентрации, температуре и т.д. В силу этих причин одни участки поверхности металла имеют более электроположительный потенциал и являются катодами по сравнению с другими являющимися анодами. Возможность протекания анодного и катодного процессов на различных участках поверхности обусловлена наличием электронной проводимости металла и ионной проводимости раствора. Эти участки представляют собой коррозионные гальванические пары или коррозионные элементы.
Таким образом, электрохимическая коррозия металлов является результатом работы большого количества коррозионных элементов на поверхности металла, соприкасающейся с электролитом. В первом приближении эту поверхность можно рассматривать как двухэлектродную (бинарную) систему, то есть состоящую из участков двух видов: анодных (одного типа) и катодных (тоже одного типа).
В этой смысле протекание электромеханического коррозионного процесса аналогично работе короткозамкнутого гальванического элемента. Материальный эффект работы такого элемента проявляется в виде растворения металла на его анодных участках, что и обусловливает разрушение металлов при электрохимической коррозии.
При замыкании в электролите двух электродов с разными потенциалами происходит перетекание электронов от более отрицательного электрода (анода) к менее отрицательному (то есть более положительному) электроду (катоду). Это перетекание электронов выравнивает значения потенциалов замкнутых электродов, и если бы электродные процессы (анодный и катодный) не протекали, потенциалы электродов сравнялись бы, наступила бы их полная поляризация и, как следствие - прекращение коррозии. В действительности анодный и катодный процессы протекают, препятствуя наступлению полной поляризации, то есть действуют деполяризующе. Поэтому атомы, молекулы иди ионы, обеспечивающие протекание катодного процесса, называются "деполяризаторами".
В нейтральных электролитах - при атмосферной коррозии, в пресной и морской воде, в почве - деполяризатором служат молекулы кислорода (коррозия с кислородной деполяризацией).
В кислых электролитах, то есть в растворах кислот, деполяризатором являются ионы водорода (коррозия с водородной деполяризацией).
Величина электрического тока, протекающего за счет движения электронов от анода к катоду в металле и ионов в электролите, характеризует интенсивность работы коррозионного элемента, то есть скорость коррозии данной бинарной системы. Этот электрический ток называется коррозионным током и определяется выражением
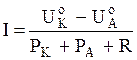
где 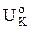 - начальный потенциал катодного процесса деполяризации;
- начальный потенциал катодного процесса деполяризации;
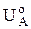 - начальный потенциал анодного растворения металла;
- начальный потенциал анодного растворения металла;
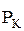 - катодная поляризуемость;
- катодная поляризуемость;
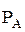 - анодная поляризуемость;
- анодная поляризуемость;
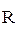 - омическое сопротивление коррозионного элемента.
- омическое сопротивление коррозионного элемента.
Таким образом, величина 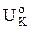 -
- 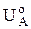 может рассматриваться как движущая сила коррозионного процесса или термодинамическая неустойчивость данной коррозионной системы, а величина РК +РА +R - как степень торможения коррозионного процесса.
может рассматриваться как движущая сила коррозионного процесса или термодинамическая неустойчивость данной коррозионной системы, а величина РК +РА +R - как степень торможения коррозионного процесса.
Величина коррозионных весовых потерь металла Dq пропорциональна силе коррозионного тока I , то есть :
Dq = k I ,
где Dq – потеря веса металла, г:
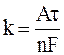 ,
,
Здесь 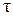 - время коррозии, с;
- время коррозии, с;
А – атомный вес металла;
n – валентность металла в данном коррозионном процессе;
F – постоянная Фарадея, F = 96500А с/г – экв.
Следовательно
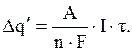 (1)
(1)
Коррозионные весовые потери могут быть определены также путем непосредственного взвешивания образца металла до испытаний и после
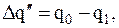 (2)
(2)
где 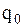 - вес образца до испытания, г;
- вес образца до испытания, г;
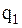 - вес образца после испытания, г.
- вес образца после испытания, г.
Для возможности сравнения коррозионной стойкости различных металлов используется весовой показатель коррозии, определяемый по формуле
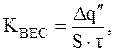 (3)
(3)
где S – площадь коррозирующей поверхности металла, м2;
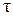 - время коррозии, ч.
- время коррозии, ч.
Степень изменения скорости анодной и катодной реакции зависит от природы металлов, то есть значений их электродных потенциалов, поляризуемости электродных процессов, относительной величины анодных и катодных поверхностей, а также от природы концентрации и температуры электролита.
В реальных условиях рассмотренный характер работы коррозионного гальванического элемента наиболее близко соответствует процессу контактной коррозии деталей машин и металлоконструкций.
Дата добавления: 2015-08-01; просмотров: 3117;
