Теоретична частина. Розчинаминазиваються гомогенні термодинамічно стійкі системи змінного складу з двох і більшого числа компонентів і продуктів їх взаємодії
Розчинаминазиваються гомогенні термодинамічно стійкі системи змінного складу з двох і більшого числа компонентів і продуктів їх взаємодії.
Наприклад, розчин сульфатної кислоти складається з розчинника – води (перший компонент), розчиненої речовини – кислоти (другий компонент) і продуктів їх взаємодії – гідратованих іонів: Н+, НSO42-, SO42-; розчин гідроксиду калію – з води, гідроксиду калію і гідратованих іонів К+ і ОН-.
Розчини класифікують за:
- розміром частинок розчиненої речовини (істинні розчини й каламутні);
- агрегатним станом розчинника і розчиненої речовини (гази, рідкі, тверді).
Найбільше практичне значення мають рідкі розчини, зокрема водні. Рідкі розчини утворюються під час розчинення газів, рідин або твердих речовин у рідкому розчиннику.
Важливою характеристикою будь-якого розчину є його склад. Існують різні способи чисельного вираження складу розчинів: масова частка розчиненої речовини, молярна, нормальна концентрації тощо.
Масова частка розчиненої речовини –це безрозмірна фізична величина, що дорівнює відношення маси розчиненої речовини до загальної маси розчину.
Масову частку виражають у частках одиниці або у відсотках (0,5 або 50%) і позначають літерою ω (омега).
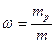 , ,
| (1) |
де ω – масова частка розчиненої речовини; mp – маса розчиненої речовини; m – загальна маса розчину.
Наприклад, масова частка розчиненої речовини – сульфатної кислоти у воді дорівнює 0,02 або 2%. Це означає, що в розчині сульфатної кислоти масою 100 г міститься сульфатна кислота масою 2 г і вода масою 98 г.
Молярна концентрація або молярність –це величина, що дорівнює відношенню кількості розчиненої речовини до об‘єму розчину, тобто
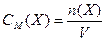 , моль/л , моль/л
| (2) |
де СМ (Х) – молярна концентрація частинок Х; n (Х) – кількість речовини частинок, що містяться в розчині, моль; V – об‘єм розчину, л.
Якщо об’єм розчину виражений в см3 (мл), то:
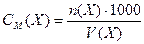 , моль/л , моль/л
| (3) |
Кількість речовини – це відношення маси речовини m (Х) до молярної маси речовини М (Х):
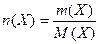 , моль , моль
| (4) |
Тоді
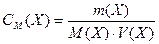 , моль/л , моль/л
| (5) |
де m (Х) – маса речовини, г; М (Х) – молярна маса речовини, г/моль; V (Х) – об'єм розчину, л.
або
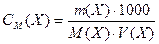 , моль/л , моль/л
| (6) |
де V(Х) – об'єм розчину, мл.
Якщо См=1 моль/л, то це – одномолярний розчин (або 1М),
См=0,1 моль/л – децимолярний розчин (або 0,1М),
См=0,01 моль/л – сантимолярний розчин (або 0,01М).
Нормальна концентраціяабо нормальність вказує на кількість грам-еквівалентів речовини, що розчинені в 1 л розчину:
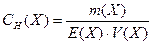 , г-екв/л , г-екв/л
| (7) |
де СН (Х) – нормальна концентрація частинок Х; Е (Х) – кількість грам-еквівалентів речовини частинок, що містяться в розчині, г-екв; V – об‘єм розчину, л.
Якщо об'єм розчину в мл, то:
 , г-екв/л , г-екв/л
| (8) |
При обчисленні еквівалентів сполук типу основ, кислот і солей можна користуватися такими правилами:
1. Еквівалент основи (ЕО) дорівнює молекулярній масі основи MrO, поділеній на число атомів груп ОН у його молекулі NOH-:
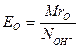
| (9) |
2. Еквівалент кислоти (ЕК) дорівнює молекулярній масі кислоти MrК, поділеній на її основність NH+. Основність кислоти визначається числом атомів гідрогену у її молекулі, які можуть заміщатися на метал :
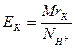
| (10) |
3. Еквівалент солі (ЕС) дорівнює молекулярній масі солі MrС, поділеній на добуток валентності металу (Вал.) і числа його атомів NМе:
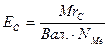
| (11) |
Якщо СН(Х) = 1 моль/л, то це – однонормальний розчин (або 1н),
СН(Х) = 0,1 моль/л – децинормальний розчин (або 0,1н),
СН(Х) = 0,01 моль/л – сантинормальний розчин (або 0,01 н).
Дата добавления: 2015-07-24; просмотров: 1039;
