Фибриллярные белки
Как уже говорилось выше, структура биополимеров теснейшим образом связана с их биологической функцией. Для того чтобы выполнять структурную функцию (волосяной покров, укрепление стенок клетки, цитоскелет клетки и т.п.), белок должен обладать вытянутой нитевидной структурой и не растворяться в воде. Такие белки называются фибриллярными.
Особенности конформации фибриллярных белков:
1) Существование вытянутой нитевидной структуры белка возможно только при условии высокой степени структурированности его молекулы, т.е. формировании вторичной структуры (α-спиральной или β-складчатой) практически на всём протяжении полипептидной цепи (более 80%).
2) Кроме того, в первичной структуре должны преобладать неполярные и незаряженные аминокислоты. Высокая степень структурированности фибриллярных белков не позволяет им сворачиваться в компактные структуры (глобулы). Поэтому гидрофобные радикалы аминокислотных остатков развёрнуты в стороны воды, что обеспечивает нерастворимость фибриллярных белков в воде.
α-Структурные фибриллярные белки, сложены из длинных перевитых спиралей (суперсперализация) (Рис. 2.2):
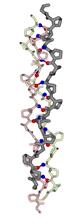
Рис. 2.2. Структура фибриллярных белков: явление суперспирализации
В α-кератине (рис. 2.3) такие спирали охватывают всю белковую цепь, — да и большая часть миозиновой цепи образует фибриллу такого типа. Такие структуры содержатся также в шелке — но не обычном шелке тутового шелкопряда, а шелке пчел и муравьев.

Рис. 2.3. Перевитые правые α-спирали. В комплексе они лежат параллельно друг другу и слегка закручены одна вокруг другой так, что каждая из них образует левую суперспираль.
Характеристика структуры молекулы коллагена. Особняком стоит тройная спираль коллагена - основного белка соединительной ткани
(Рис. 2.4):

Рис. 2.4. Структура молекулы коллагена
а) молекула коллагена построена из трёх полипептидных цепей. Каждая полипептидная цепь содержит около 1000 аминокислотных остатков (35% - глицин, 21% - пролин и оксипролин, 11% - аланин);
б) полипептидные цепи коллагена построены из чередующихся блоков --гли–х–про- или -гли–х–оксипро- (х - аланин или другие аминокислоты). Как пролин, так и оксипролин препятствуют образованию α‑спиралей и
β-складок;
в) каждая полипептидная цепь имеет конформацию плотной (3 аминокислотных остатка на виток) левозакрученной спирали (спирализация 1-го порядка);
г) в молекуле коллагена эти три спирали перевиты друг с другом, в результате чего образуется тройная суперспираль коллагена (спирализация 2-го порядка), которая принципиально отличается от α‑спирали. Это очень слабо закрученная (один оборот на 10 000 нм) правая спираль;
д) между спиралями 1-го порядка за счёт пептидных групп образуются водородные связи.
Такое строение обеспечивает прочность коллагеновых волокон.
Дата добавления: 2015-07-24; просмотров: 1450;
