ОБРАТИМОЕ 2. НЕОБРАТИМОЕ
ВИДЫ ИНГИБИРОВАНИЯ
А. КОНКУРЕНТНОЕ А. СПЕЦИФИЧЕСКОЕ
Б. НЕКОНКУРЕНТНОЕ Б. НЕСПЕЦИФИЧЕСКОЕ
Обратимое ингибирование. Большинство ингибиторов действуют обратимо, образуя нековалентные связи с ферментом, и при определенных условиях диссоциируют с восстановлением активности фермента.
Конкурентное ингибирование. Ингибитор похож на субстрат фермента по своей структуре и соперничает с субстратом за активный центр (садится на активный центр фермента), что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата.
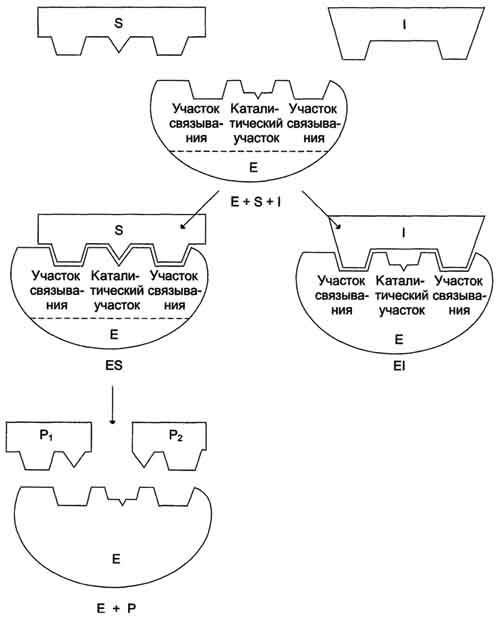
Для конкурентного типа ингибирования справедливы следующие уравнения:
Е + S ⇔ ES → E + P,
E + I ⇔ EI.
1. Конкурентное взаимодействие этанолаи метанолаза активный центр алкогольдегидрогеназы.
2. Ингибирование сукцинатдегидрогеназы малоновой кислотой, структура которой схожа со структурой субстрата этого фермента – янтарной кислоты (сукцината).
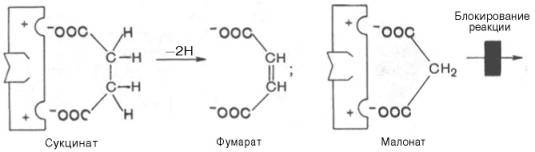
Сукцинат + ФАД ----------- Фумарат + ФАДН2
3.Также к конкурентным ингибиторам относят антиметаболиты или псевдосубстраты, например, антибактериальные средства сульфаниламиды, схожие по структуре с п-аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке конкурентно нарушается использование п-аминобензойной кислоты для синтеза фолиевой кислоты, что и вызывает лечебный эффект.
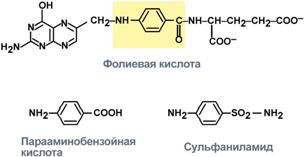
Сходство строения сульфаниламидов
и парааминобензойной кислоты, компонента витамина В9
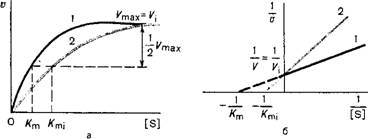
Влияние различных концентраций субстрата на скорость реакции, катализируемой ферментами 1 и 2(в присутствии ингибитора): а) гиперболическая зависимость V от [S], б) прямая зависимость в обратных координатах 1/V от 1/[S] - Лайнуивера-Бэрка.
Конкурентные ингибиторы уменьшают скорость химической реакции. Конкурентный ингибитор повышает Кm для данного субстрата (уменьшает сродство субстрата к ферменту). Это означает, что в присутствии конкурентного ингибитора необходима большая концентрация субстрата для достижения 1/2 Vmax. Увеличение соотношения концентрации субстрата и ингибитора снижает степень ингибирования. При значительно более высоких концентрациях субстрата ингибирование полностью исчезает, потому что активные центры всех молекул фермента будут находиться преимущественно в комплексе с субстратом.
Неконкурентное ингибирование. Ингибитор не имеет структурного сходства с субстратом и присоединеняется не в активном центре, а в другом месте молекулы, одновременно с субстратом. Образуется тройной комплекс: субстрат - фермент - ингибитор. Это ведет к деформации активного центра и каталитической активности. Например, синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание.
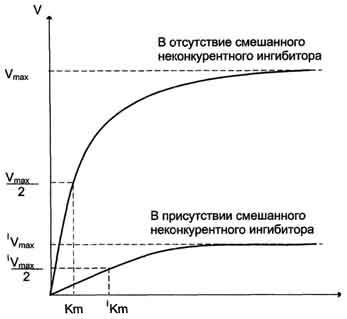
Кинетическая зависимость неконкурентного ингибирования: характеризуется снижением Vmax ферментативной реакции и уменьшением сродства субстрата к ферменту, т.е. увеличением Кm.
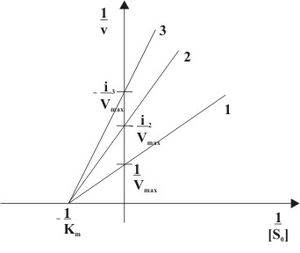
Неконкурентное ингибирование в двойных обратных координатах при различных концентрациях ингибитора (1 - [I]=0; 2 - [I]>0; 3 - [I]>[I]2).
При неконкурентном ингибировании константа Михаэлиса не изменяется, а максимальная скорость реакции уменьшается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах семейство прямых, отвечающих разным концентрациям ингибитора, пересекается в одной точке на оси абсцисс. Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию.
К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению (рис. 2-26). При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента.
1. Специфические и неспецифические
ингибиторы
Использование необратимых ингибиторов представляет большой интерес для выяснения
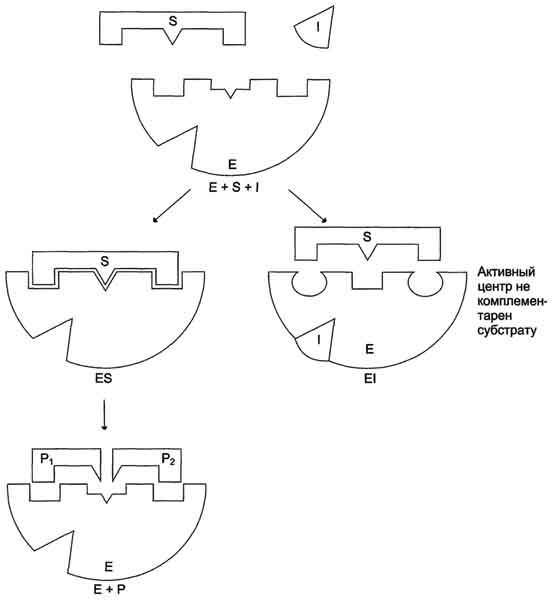
Бесконкурентное ингибирование.При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор меняет конформацию фермента таким образом, что катализ становится невозможным.Для него характерно то, что V и Км изменяются в одинаковой степени.
Ингибирование субстратом — частный случай бесконкурентного ингибирования, когда две молекулы субстрата связываются с ферментом, что препятствует образованию продукта.
Аллостерическое ингибирование: ингибиторы связываются с отдельными участками фермента вне активного центра. Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности. Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию.
К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению. При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента. 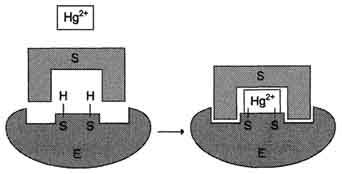
Специфические и неспецифические ингибиторы
Использование необратимых ингибиторов представляет большой интерес для выяснения механизма действия ферментов. С этой целью применяют вещества, блокирующие определённые группы активного центра ферментов. Такие ингибиторы называют специфическими. Ряд соединений легко вступает в реакции с определенными химическими группами. Если эти группы участвуют в катализе, то происходит полная инактивация фермента. Диизопропилфторфосфат (ДФФ) относят к специфическим необратимым ингибиторам "сериновых" ферментов, так как он образует ковалентную связь с гидроксильной группой серина, находящегося в активном центре и играющего ключевую роль в процессе катализа. 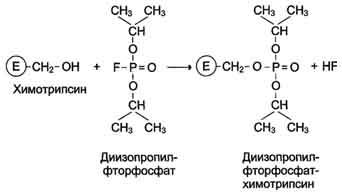
Ацетат йода, п-хлормеркурибензоат легко вступают в реакции с SH-группами остатков цистеина белков. Эти ингибиторы не относят к специфичным, так как они реагируют с любыми свободными SH-группами белков и называются неспецифическими ингибиторами. Если SH-группы принимают участие непосредственно в катализе, то с помощью этих ингибиторов представляется возможным выявление роли SH-групп фермента в катализе.
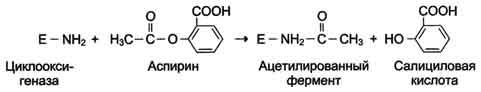
Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, - широко используемый препарат аспирин. Противовоспалительный нестероидный препарат аспирин обеспечивает фармакологическое действие за счёт ингибирования фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты. В результате химической реакции ацетильный остаток аспирина присоединяется к свободной концевой NH2-группе одной из субъединиц циклооксигеназы. Это вызывает снижение образования продуктов реакции простагландинов, которые обладают широким спектром биологических функций, в том числе являются медиаторами воспаления.
Основные способы регуляции активности ферментов:
- аллостерическая регуляция;
- регуляция с помощью белок-белковых взаимодействий;
- регуляция путём фосфорилирования/дефосфорилирования молекулы фермента;
- регуляция частичным (ограниченным) протеолизом.
Дата добавления: 2015-07-24; просмотров: 5421;
