Щелочно-алюмосиликатные стекла.
Структурная роль алюминия (Al) в стекле идентична его роли в кристаллических алюмосиликатах, т.е. катионы А13+ могут находиться в четверной или шестерной координации по кислороду и образовывать координационные тетраэдры типа А104 (тетраэдры) и А106 (октаэдры).
Условием существования алюминия в том или ином координационном состоянии в силикатных стеклах является соотношение между концентрацией щелочных (или щелочноземельных) оксидов и оксида А1203. При соотношениях Ме20/А1203>1 А13+ присутствует в стекле в тетраэдрическом окружении. Следует обратить внимание на то, что группировка [А104]5- в силикатных стеклах не существует самостоятельно. Она устойчива только в том случае, если вблизи тетраэдра [А104]5- расположен ион щелочного металла, например, натрия. Стабильной в этом случае является не просто группировка [А104]5- а группа атомов [(А104)5-На+]4- , в которой ион натрия не связан с каким-либо определенным атомом кислорода, а локализован на тетраэдре [А104]5- частично компенсируя отрицательный заряд анионной группировки.
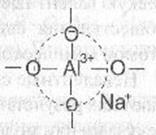
Атомы кислорода в вершинах тетраэдра А104 в этом случае являются мостиковыми и могут принимать участие в образовании химической связи с кремнекислородными тетраэдрами. Как и в кристаллических силикатах, тетраэдрические группировки алюминия могут, наравне с тетраэдрами SiO4, участвовать в построении структурного каркаса стекла, сочленяясь с ними вершинами. Образуется смешанная алюмокремнекислородная сетка.

При введении оксида алюминия в щелочно-силикатное стекло повышается степень связности структурной сетки, т.к. он встраивается в кремне-кислородный каркас и наряду с этим изменяет структурную роль щелочного компонента.
Наиболее благоприятные возможности для изоморфного замещения ионов кремния на ионы алюминия создаются в присутствии катионов №+, К+, Са2+.
Существование алюминия в стеклах в шестерной координации наиболее вероятно в бесщелочных и малощелочных составах с выраженным кислотным характером. Щелочноземельные катионы малого радиуса Ве2+, Мg2+ способствуют стабилизации в стекле алюминия, являющегося модификатором.
9.Валентно-химическое описание строения стекла.
Химическая связь между атомами возникает как результат электростатического (кулоновского) взаимодействия электронов и ядер атомов.
Химические связи в веществах могут быть: валентные и ковалентные. Валентные связи возникают в результате перераспределения электронной плотности в системе атомов, участвующих в химической реакции. Различают ионную, ковалентную, донорно-акцепторную, дативную, металлическую валентные связи, отличающиеся друг от друга степенью обобществления связевых электронов парой атомов или группой атомов химического соединения.
Невалентные связи возникают в результате электростатического взаимодействия между молекулами или молекулярными группировками вещества. Образование невалентных связей не сопровождается передачей электронов, но обусловлено индукционным, ориентационным или дисперсионным взаимодействием молекул или молекулярных образований.
В стеклах, как и в кристаллических твердых телах, невозможно выделить участки структуры, которые можно было бы считать отдельными молекулами. В силу этого в твердых телах, в отличие от жидких и особенно газообразных, преобладает действие прочных валентных связей.
10. Химическая связь в стеклах, в соответствии с электронной теорией.
Согласно классической электронной теории, химическая связь в кварцевом стекле является преимущественно ковалентной (степень ионности 50%). В бинарных щелочно-силикатных стеклах типа Ме20—SiO2можно выделить два вида ионно-ковалентных связей: преимущественно ковалентные в цепочках атомов
-Si-О-Si-
и более ионные связи между щелочными катионами и анионным каркасом, т.е. связи типа -Ме-О-Si-.
— Степень ионности — ковалентности связей Si—О , Ме—О не является постоянной для всех видов стекол и зависит от состава стекла в целом.
Дата добавления: 2015-07-22; просмотров: 1819;
