ГЛАВА 123. НЕВЕНЕРИЧЕСКИЕ ТРЕПОНЕМАТОЗЫ: ФРАМБЕЗИЯ, ПИНТА, ЭНДЕМИЧНЫЙ СИФИЛИС
Питер Л. Перайн (Peter L. Ferine)
Общие положения. Невенерические трепонематозы распространены в экономически слабо развитых регионах. Фрамбезия, пинта и эндемичный сифилис отличаются от венерического сифилиса только по клиническим и эпидемиологическим показателям. Фрамбезию и пинту вызывают трепонемы, условно объединенные в один род микроорганизмов (возбудителем фрамбезии служит Treponema pertenue, пинты — Т. carateum), однако до сих пор не установлено никаких убе дительных морфологических или антигенных различий между Т. pertenue, Т. carateum и Т. pallidum. Этиологический агент эндемичного сифилиса обычно отождествляется с Т. pallidum и иногда обозначается как Т. pallidum endemicum. При пинте поражаются кожные покровы, при фрамбезии — кожные покровы и кости, а при эндемическом сифилисе—кожные покровы, кости и слизистые оболочки. Все эти заболевания имеют тенденцию развиваться и прогрессировать по определенным стадиям, которые, однако, никогда не бывают так четко выражены и точно предсказуемы, как при сифилисе. Врожденные формы заболевания и поражения сердечно-сосудистой и центральной нервной системы наблюдаются редко или совсем не выявляются при невенерических трепонематозах, тогда как весьма распространены при сифилисе. Совершенно не ясно, обусловлены ли клинические и эпидемиологические различия фрамбезии, пинты, эндемичного сифилиса и венерического сифилиса определенными факторами микроорганизма и окружающей среды или же они являются результатом неустановленных еще биологических различий этиологических агентов. Взаимоотношения трепонематозов суммированы в табл. 123-1.
Таблица 123-1. Этиология, эпидемиология и клинические проявления трепонематозов
| Возбудитель | Венерический сифилис Т. pallidum | Эндемичный сифилис Т. pallidum endemicum | Фрамбезия Т. pertenue | Пинта Т. carateum |
| Пути передачи | Половой, трансплацентарный | Домашние контакты: через рот, через посуду при приеме жидкостей и пищи | Чрескожный ? Через насекомых | Чрескожный ? Через насекомых |
| Восприимчивый возраст | Взрослый | Ранний детский | Ранний детский | Подростковый |
| Первичный очаг | 1\0?КНЭЯ ЯЗВЭ (шанкр) | г едко выявляется | Фрамбезиома (малина), или «материнская фрамбезия» | Неизъязв-ляющаяся папула с сателлитами |
| Вторичный очаг | Слизисто-кожный очаг; иногда периостит | Цветущие слизисто-кожные очаги (слизистые пятна, папулы, широкие кондиломы); остеопериоститы | Кожные папуло-чешуйчатые очаги; остеопериоститы | Пинтиды |
| Третичный | Гумма, сифилис сердечно-сосудистой и центральной нервной системы | Деструктивные кожные костно-суставные гуммы | Деструктивные кожные костно-суставные гуммы | Дисхроматическне, ахроматические пятна |
Так как невенерические трепонематозы обычно приобретаются в детстве и трепонемная бактериемия развивается с течением времени, то передача инфекции при рождении от матери ребенку возможна только при проявлениях венерического сифилиса взрослых.
Эпидемиология. У некоторых популяций низших приматов выявляются антитела к трепонемам в тех районах Африки, где широко распространены заболевания людей фрамбезией и эндемичным сифилисом, а в кожных очагах поражения и в лимфатических узлах животных, дающих положительные серологические реакции, обнаруживаются патогенные трепонемы. Эти трепонемы вызывают образование очагов, напоминающих таковые при фрамбезии, у чувствительных к инфекции обезьян и хомяков.
Фрамбезией и эндемичным сифилисом болеют главным образом дети. Фрамбезия распространена во всем мире в районе тропиков Рака и Козерога, во влажном теплом климате. Распространению фрамбезии среди детей способствуют низкий уровень жизни, несоблюдение правил гигиены, частые травмы кожных покровов. Распространение возбудителя происходит при прямом контакте с очагом поражения и, вероятно, при пассивном переносе возбудителя насекомыми. Эндемичный сифилис распространен в сухом субтропическом или умеренном климате на континенте Африки, в восточном Средиземноморье, на Арабском полуострове и в центральной Азии, но не встречается в западном полушарии. Прямой кожный контакт как возможный путь заражения наблюдается реже, чем при фрамбезии. Поражение слизистых оболочек значительно чаще отмечается при прямом контакте через рот или загрязненные предметы домашнего обихода, такие как посуда и кухонная утварь. Венерический сифилис может распространяться и неполовыми путями, особенно среди детей; в этом случае наблюдаются домашние вспышки инфекции, когда скученность и нищета благоприятствуют распространению возбудителя.
Пинта — наиболее доброкачественное заболевание этой группы, наблюдающееся только в западном полушарии, хотя некоторые кожные очаги измененной пигментации, напоминающие поздние стадии пинты, могут наблюдаться при фрамбезии и эндемичном сифилисе. Болеют в основном дети в возрасте от 10 до 20 лет. Пинта относится к высококонтагиозным болезням, пути ее распространения окончательно не установлены.
Массовая кампания по ликвидации эндемических невенерических трепонематозов, проведенная по инициативе Всемирной организации здравоохранения и Фонда ООН помощи детям в период с 1948 по 1969 г., оказалась необычайно успешной. В 46 странах было обследовано более 160 млн человек и приблизительно 50 млн больных, контактных лиц и носителей скрытой инфекции были подвергнуты лечению. Эта программа имела большое значение. Во многих регионах, особенно сельских, распространенность активных случаев заболевания фрамбезией снизилась более чем с 20% до 1%. В Боснии (Югославия) эндемичный сифилис был ликвидирован — это единственный пример полной ликвидации эндемического трепонематоза.
Ослабление деятельности по активному выявлению фрамбезии после массовой кампании привело к росту заболеваемости, особенно в Африке. Болезнь не удалось полностью ликвидировать в какой-либо обширной области. Берег Слоновой Кости, Гана, Того и Бенин имеют большие резервуары фрамбезии, и выявляемые в этих странах заболевания составляют более 90% всех случаев, зарегистрированных ВОЗ с 1982 г. В северных районах этих стран, а также среди населения Мали, Нигера, Буркина Фасо и Сенегала в некоторых районах распространенность эндемичного сифилиса достигает от 10 до 15%. Эти показатели превышают цифры, полученные ранее при проведении массовой кампании по выявлению и лечению больных. Случаи серологически активных заболеваний и поздних проявлений эндемичного сифилиса продолжают выявляться среди кочевников в Саудовской Аравии. Возрождение заболеваемости фрамбезией и эндемичным сифилисом привело к новой кампании по борьбе с фрамбезией в Гане в 1980 г. Планируются новые кампании по борьбе с фрамбезией и эндемичным сифилисом в странах Африки.
После проведения в некоторых районах (Нигерия, Новая Гвинея, Босния) массовых кампаний у новорожденных, не имеющих никаких клинических проявлений болезни, процент положительных антител к трепонемам и реагинам был весьма низким. Эти данные могут отражать наличие аттенуированной или бессимптомной инфекции или же просто указывать на снижение прогностической ценности серологических исследований (вероятность наличия заболевания, если серологическая реакция положительная), когда распространенность болезни резко снижается.
На Американском континенте очаги фрамбезии существуют на Гаити, в Доминиканской Республике, Санта-Лючии, Перу, Колумбии и Эквадоре, некоторых районах Бразилии, Гвианы, Суринама. Локализация пинты ограничена Центральной Америкой и северными районами Южной Америки, где она сосредоточена в отдаленных поселениях индейцев. Ее распространенность в настоящее время, вероятно, составляет менее 1% от уровня заболеваемости, наблюдаемого 20 лет назад.
Биологические взаимоотношения. Специфические антитела к Т. pallidum вырабатываются у лиц, больных фрамбезией, пинтой или эндемичным сифилисом, но время появления этих антител после начала заболевания варьирует. Ни один из применяемых тестов: тест абсорбции флюоресцирующих антител к трепонемам (FTA-ABS), тест гемагглютинации Т. pallidum (TPHA), тест иммобилизации Т. pallidum (TPI) — не позволяют проводить дифференциальную диагностику трепонематозов.
Кроме различий в клинических и эпидемиологических проявлениях трепонематозов у людей, различны также чувствительность к ним животных и некоторые проявления экспериментальных инфекций. В частности, Т. carateum вызывает у шимпанзе инфекцию, напоминающую пинту, но попытки заразить ею других экспериментальных животных оказались безуспешными. Были установлены различия в характере заболеваний, возникающих у кроликов и золотистых хомячков при заражении их Т. pallidum и Т. pertenue. Экспериментальное заражение кроликов одним из видов трепонем вызывает более выраженный иммунитет к последующему повторному заражению гомологичным, чем гетерологичным, видом. Однако эти межвидовые различия в иммунитете к суперинфекции выражены не больше, чем внутривидовые различия между разными штаммами Т. pallidum. Лица, перенесшие фрамбезию или пинту, считаются относительно иммунными к сифилису, а лица с активной пинтой или сифилисом не поддаются суперинфекции Т. pertenue при экспериментальном заражении.
Клинические проявления. Фрамбезия. Фрамбезия, также известная как контагиозное тропическое заболевание кожи, южноамериканский лейшманиоз — хроническое инфекционное заболевание детей, вызываемое Т. pertenue и характеризующееся первоначальным кожным очагом (очагами), вслед за которым развиваются рецидивирующие, недеструктивные вторичные очаги на коже и в костях. На поздних стадиях заболевания выявляются деструктивные поражения кожных покровов, костей и суставов.
Инкубационный период после экспериментального заражения чувствительных к инфекции людей колеблется от 3 до 4 нед. Повреждения кожных покровов при укусах насекомых, ссадинах или травмах усиливают восприимчивость к инфекции; наиболее часто распространение возбудителя осуществляется пальцами рук, загрязненными при прямом или непрямом контакте с материалом из более ранних очагов инфекции. Первоначальный ранний очаг проявляется в виде единичной папулы, которая обычно локализуется на нижних конечностях. Размер очага поражения увеличивается, он приобретает папилломатозный характер. Этот очаг известен как фрамбезиома (малина), или «материнская фрамбезия». Поверхностные слои ее постепенно разрушаются, и она покрывается тонким желтоватым налетом серозного экссудата, содержащего Т. pertenue. Эритема и уплотнение очага не развиваются, однако отмечают слабый зуд и регионарную лимфаденопатию. Первичный очаг поражения обычно заживает в течение 6 мес. В результате бактериемии, вызванной трепонемами, и аутоинфекции развивается вторичное генерализованное высыпание однообразных кожных очагов, проявляющееся до или после окончательного заживления первичного очага и наиболее интенсивно выраженное на обнаженных поверхностях тела. Проявляются ранние кожные очаги фрамбезии в десквамативно-папулезной, макулезной или папилломатозной форме (рис. 123-1). Болезненные папилломы на подошвах приводят к образованию глубоких трещин и резкой болезненности при ходьбе, у больных проявляются симптомы так называемой походки краба (crab yaws). Заживление ранних очагов происходит медленно и они длительное время остаются источником распространения возбудителя; затем происходит их рубцевание, гиперпигментация или депигментация, напоминающие изменения пигментации, характерные для пинты. При гистологическом исследовании выявляют инфильтрацию мононуклеарными клетками, акантоз (рис. 123-2), гиперкератоз и обилие трепонем. К другим
Рис. 123-1. Ранние очаги фрамбезии с подкожными околосуставными узлами (левая рука).
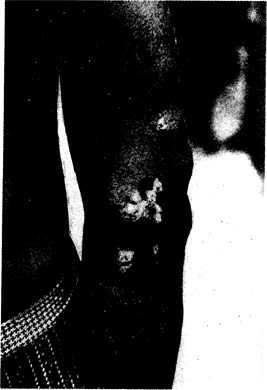
проявлениям ранней фрамбезии относятся лимфаденопатия, боли в костях в ночное время суток и полидактилиты, вызванные периоститами. Повышение температуры тела и другие конституциональные симптомы наблюдаются редко, однако это состояние продолжается до тех пор, пока очаги не реинфицируются. Рецидивирующее инфицирование кожных очагов является характерным проявлением фрамбезии в течение 5 лет после первичного заражения. Поздние очаги развиваются примерно у 10% больных через 5 и более лет после заражения, и в отличие от ранних очагов гистологическими методами в них обнаруживают проявления эндартериита. К поздним очагам относятся гуммы кожи и длинных трубчатых костей, особенно нижних конечностей, гиперкератоз подошв и ладоней, оститы, периоститы, узловатые околосуставные фиброматозные образования и гидрартрозы.
Поздние очаги фрамбезии обычно характеризуются большей интенсивностью и склонностью к деструкции. Деструктивные поражения носа, верхней челюсти, неба и глотки, получившие название гангоза, или обезображивающий ринофарингит, наблюдаются в позднем периоде течения фрамбезии, как и при лепре и лейшманиозе. Гипертрофические параназальные оститы верхней челюсти формируют типичную картину лица, получившую название гунду.
Клинические проявления фрамбезии имеют в настоящее время меньшее значение для диагностики в связи со снижением распространенности этого заболевания, однако при проведении скрининговых исследований по выявлению фрамбезии сохраняется необходимость постановки легко осуществимых серологических проб, таких как тест быстрого обнаружения реагинов в плазме (RPR), выполняемый средним медицинским персоналом в полевых условиях.
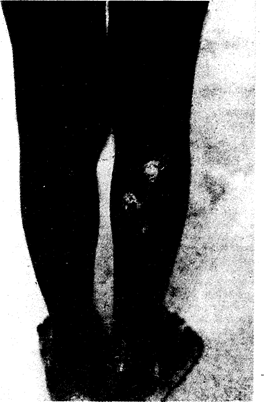
Рис. 123-2. Вторичные язвенно-папилломатозные очаги при фрамбезии (правая нога).
Т. pertenue можно выявить при исследовании в темном поле зрения материала из ранних кожных очагов, однако необходимо тщательно дифференцировать ее от других трепонем, обнаруживаемых в тропических язвах. Тесты на сывороточные реагины становятся положительными через 1 мес, тест FTA-ABS также положителен.
Эндемичный сифилис. Синонимы эндемичного сифилиса: беджель, сити, дичучва, ньювера, баляш и скерлиево. Это хроническая, невенерическая трепонемная инфекция детского возраста, характеризующаяся ранними очагами поражения, развивающимися на слизистых оболочках, или слизисто-кожными очагами, и поражающая главным образом детей. Длительность латентного периода не определена; болезнь характеризуется развитием поздних осложнений, включая гуммы костей и кожных покровов. Этиологический агент не отличим от Р. pallidum. Эндемичный сифилис отличается от врожденного значительно реже встречающимся развитием изменений зубов, интерстициальных кератитов и нейросифилиса. Осложнения со стороны сердечно-сосудистой системы наблюдаются достаточно редко как при эндемичном, так и при врожденном сифилисе.
Первичные кожные очаги поражения, локализующиеся, как правило, экстрагенитально, наблюдаются сравнительно часто. Наиболее ранним проявлением эндемичного сифилиса считается обычно бляшка (или пятно) на слизистой оболочке или слизисто-кожный очаг, напоминающий щелевидную папулу или кондилому вторичного сифилиса и располагающийся в ротовой полости. Как правило, наблюдается периостит. Отмечается регионарная лимфаденопатия, но генерализованная лимфаденопатия обычно отсутствует. Трепонемы в изобилии обнаруживаются во влажных первичных очагах и в аспиратах из регионарных лимфатических узлов. Поздние очаги развиваются после различного по продолжительности латентного периода и являются наиболее частым клиническим проявлением заболевания. Они напоминают очаги позднего доброкачественного сифилиса и выражаются костными или кожными гуммами. Значительно чаще, чем при поздней фрамбезии, наблюдаются деструктивные гуммы, оститы и периоститы костных структур назофарингеальной области. Гуммы обнаруживаются на сосках молочных желез матерей, ранее перенесших эндемичный сифилис или кормивших грудью младенцев с очагами поражения в ротовой полости. Таким образом, в одной и той же семье могут сосуществовать одновременно ранние и поздние стадии болезни. Третичные очаги эндемичного сифилиса развиваются как последствия реинфекции ранее сенсибилизированного организма.
Пинта. Пинта, известная также как «болезнь пинто», карате, азуль или пурпуру, — это инфекционное поражение кожи, вызываемое Т. carateum. Это заболевание имеет три стадии, характеризующиеся заметными изменениями окраски кожных покровов; при этом в процесс не вовлекаются костная ткань и внутренние органы; оно не приводит к инвалидности, за исключением косметических дефектов.
Начальный аффект — маленькая папула, появляющаяся через 7—30 дней после внедрения возбудителя и наиболее часто локализующаяся на конечностях, лице, шее или ягодицах. Размер папулы медленно увеличивается за счет распространения к периферии и слияния с более мелкими дочерними папулами. Отмечается регионарная лимфаденопатия. Вторичные высыпания, не связанные с генерализованной лимфаденопатией, появляются в период времени от 1 мес до 1 года после возникновения начального очага. Вторичные очаги, называемые пинтидами, достаточно многочисленны и могут иметь кольцеобразную конфигурацию или форму псориатических бляшек. Первоначально они имеют красную окраску, но постепенно пигментация их усиливается и после экспозиции на солнце с течением времени они приобретают свинцово-синий оттенок. Пигментация развивается особенно быстро на участках тела, подвергающихся воздействию солнечных лучей. Эти пигментированные очаги известны как дисхромические пятна. Содержащиеся в них трепонемы локализуются в основном в эпидермальном слое старых очагов. Гистологическими методами в дерме выявляют отложение пигмента с повышенным содержанием меланина в базальноклеточном слое. На протяжении 3 мес— 1 года большинство пинтидов подвергается депигментации, степень которой варьирует. Очаги приобретают коричневый оттенок, затем становятся белыми, придавая кожным покровам пятнистый характер. Фарфорово-белые ахроматические очаги представляют позднюю стадию болезни, характеризующуюся атрофией эпидермиса и отсутствием меланоцитов и меланина. В транссудатах из ранних, вторичных или дисхроматических очагов можно обнаружить Т. carateum. Серологические тесты на реагиновые и антитрепонемные антитела при пинте положительные, но продолжительность реакции в 4 раза дольше, чем при венерическом сифилисе.
Лечение. Лечение аналогично при всех эндемических трепонематозах. Внутримышечное введение 1 200000 ЕД бициллина-1 взрослым и 6000000 ЕД детям приводит к быстрому излечению очагов и предотвращает рецидивы. Широко применяется суспензия бензилпенициллина новокаиновой соли в масле и 2% раствор моностеарата алюминия (РАМ). Лицам с повышенной чувствительностью к пенициллину можно рекомендовать тетрациклина гидрохлорид в дозах, аналогичных тем, которые применяются при инфекционном сифилисе (см. гл. 122). В районах, где активная форма болезни отмечается менее чем у 5% населения, заболевших лечат в индивидуальном порядке, а лицам, контактировавшим с ними, проводят лечение противомикробными средствами.
Профилактика. Хотя невенерические трепонематозы поддаются ликвидации труднее, чем оспа, распространение фрамбезии позволило предположить, что при этом заболевании необходим селективный эпидемиологический контроль, как это практикуется в случае оспы. Подобная стратегия предусматривает активное выявление, исследование вспышек и лечение больных с активной формой фрамбезии, а также лиц, имевших с ними контакт, что более рационально, чем массовое лечение.
ЛАВА 124. ЛЕПТОСПИРОЗ
Джей П. Сэнфорд (Jay P. Sanford)
Определение. Лептоспироз — заболевание, вызываемое представителями рода Leptospira вне зависимости от специфического серотипа. Изучение взаимоотношения клинических синдромов и различных серотипов лептоспир позволяет сделать вывод, что один и тот же серотип возбудителя может вызывать разнообразные клинические проявления; и наоборот, один синдром, например асептический менингит, может быть обусловлен несколькими серотипами микроорганизма. Предпочтение поэтому отдается общему термину лептоспироз, а не таким его синонимам, как болезнь Вейля и собачий лептоспироз.
Этиология. Род Leptospira включает в себя только один вид, L. interrogans, который в свою очередь может быть подразделен на два комплекса — Interrogans и Biflexa. Паразитический (Interrogans) комплекс объединяет патогенные штаммы, тогда как сапрофитный (Biflexa) комплекс — сапрофитные штаммы. Каждый из этих комплексов объединяет микроорганизмы, несущие различные антигены, достаточно стабильные для того, чтобы классифицировать лептоспиры на серотипы (серовары). Серотипы с общими антигенами формируют серогруппы (виды). Таким образом, примером правильного обозначения является следующий: серогруппа Pomona вида L. interrogans или L. interrogans var. pomona, а не L. pomona. Паразитический комплекс в настоящее время содержит около 170 серотипов, составляющих 18 серогрупп (номер, указываемый в скобках, относится к номеру серотипа внутри серогруппы): Icterohemorrhagiae (18), Hendomadis (30), Autumnalis (17), Canicola (12), Australis (12), Tarassovi (17), Pyrogenes (12), Bataviae (10), Javanica (8), Pomona (8), Ballum (3), Cynopteri (3), Celledoni (3), Grippotyphosa (5), Panama (92), Shermani (1), Ranarum (2) и Bufonis (1). В Соединенных Штатах Америки выделяют по крайней мере 27 серотипов лептоспир.
Эпидемиология. Считается, что лептоспироз является наиболее распространенным зоонозом в мире. Случаи заболевания регулярно выявляются на всех континентах, кроме Антарктиды, особенно широко распространены они в тропиках. Лептоспироз зарегистрирован во всех регионах США, включая бесплодные пустыни, такие как Аризона. В период с 1974 по 1983 г. ежегодно сообщалось о 61—110 случаях заболеваний. Случаи лептосцироза у человека обычно спорадические и не играют важной роли в поддержании резервуара инфекции. Заболевание распространено у целого ряда диких и домашних животных, включая пойкилотермных позвоночных. У многих видов животных, в частности у опоссумов, скунсов, енотов и лис, процент зараженных лептоспирозом животных в популяции нередко достигает 10—50. Часто наблюдается распространение какого-либо специфического серотипа лептоспир между животными одного вида, например серотип Pomona, тесно связанный с домашним скотом, был обнаружен у собак. Степень тяжести заболевания у животных варьирует от слабовыраженной до тяжелой смертельной. Даже в случае бессимптомного течения болезни животные могут быть носителями больших количеств лептоспир в почках (более 1010 микробных тел в 1 г ткани). У многих видов животных может развиваться состояние носительства, сопровождающееся выделением лептоспиры с мочой в течение месяцев или лет. Иммунизация собак не всегда предотвращает у них состояние носительства или выделения лептоспир в окружающую среду.
Выживаемость лептоспир в природе регулируется многими факторами, включая рН мочи организма хозяина, рН почвы или воды, в которую они попадают при выделении, а также температуру окружающей среды. В участках почвы, загрязненных мочой («мочевые пятна»), лептоспиры сохраняют инфицирующие свойства в течение 6—48 ч. Кислая реакция мочи ограничивает срок выживания лептоспир; однако если реакция мочи нейтральная или щелочная и при выделении микроорганизм попадает в аналогичную по реакции влажную среду с низким содержанием солей, не загрязненную обильно другой микрофлорой или детергентами и имеющую температуру свыше 22°С, в таких условиях лептоспиры могут переживать в течение нескольких недель. У человека заболевание развивается либо в результате прямого контакта с мочой или тканями больных животных, либо передается непрямым путем через загрязненную воду, почву или другие факторы окружающей среды. У человека входными воротами инфекции, как правило, служит поврежденная кожа, особенно в области ступней, а также подвергающиеся воздействию инфекционного материала слизистые оболочки конъюнктивы, носовой или ротовой полости. Ранее существовавшая концепция, что возбудитель может пенетрировать неповрежденную кожу, в настоящее время является спорной. Несмотря на то, что лептоспиры были выделены из организма клещей, роль этих насекомых в переносе инфекции считается несущественной.
В связи с повсеместным распространением зараженных животных лептоспирозом могут поражаться люди различных возрастных групп вне зависимости от половой принадлежности. Однако это прежде всего болезнь подростков и людей среднего возраста (около 50% больных в возрасте от 10 до 39 лет). Заболевание поражает преимущественно мужчин (80%) и развивается чаще в период жаркой погоды: в США 50% заболеваний приходится на период с июля по октябрь, хотя ярко выраженной сезонности у лептоспироза нет. Широкий спектр животных, являющихся источниками инфекции, обусловливает распространение заболевания как среди сельских, так и среди городских жителей. Лептоспироз считался профессиональным заболеванием, однако усиление борьбы с крысами и улучшение гигиенических условий снизили заболеваемость среди профессиональных групп, таких как шахтеры, работники, обслуживающие канализационные системы. Впоследствии эпидемиологическая ситуация изменилась; в США и Великобритании наиболее распространен лептоспироз, связанный с водными источниками и зараженным крупным рогатым скотом. В настоящее время менее 20% больных имеют прямой контакт с животными; это преимущественно фермеры, конюхи или работники скотобоен. У большинства больных заражение происходит случайно; около 60% заболеваний наблюдаются у детей, студентов или домашних хозяек. Плавание или частичное погружение в загрязненную лептоспирами воду, например, проезд на мотоцикле через загрязненный водоем, рассматривается как причина заражения у 20% больных, а также причина большинства зарегистрированных массовых вспышек заболевания. На Гавайях 20% случаев заболевания связывается с индустрией водных культур, тогда как в Италии лептоспироз остается наиболее распространенным в районах выращивания риса в долине реки По.
Патологические изменения. У больных, умерших при значительных поражениях печени и почек (синдром Вейля), отмечают наличие кровоизлияний и желчного окрашивания тканей. Многочисленные кровоизлияния, интенсивность которых варьирует от петехиальных до более выраженных, наиболее интенсивны в области скелетных мышц, почек, надпочечников, печени, желудка, селезенки и легких.
В скелетных мышцах обнаруживаются типичные для лептоспироза фокальные некротические и некробиотические изменения. Биопсии, выполненные на ранних фазах заболевания, выявляют отек и вакуолизацию. С помощью техники флюоресцирующих антител в этих очагах обнаруживается антиген лептоспир. Заживление происходит за счет формирования новых миофибрилл с минимальным фиброзом. В период острой фазы болезни в почках развиваются очаги поражения, локализующиеся в основном в канальцах. Степень выраженности патологических изменений в канальцах варьирует от простого расширения дистальных извитых канальцев до дегенерации, некроза и рубцевания базальных мембран. Неизменно обнаруживаются интерстициальный отек и клеточная инфильтрация, преимущественно лимфоцитов, нейтрофильных лейкоцитов, гистиоцитов и плазматических клеток. Очаговые изменения в клубочках либо полностью отсутствуют, либо представлены мезангиальной гиперплазией и фокальными процессами выпотевания, которые интерпретируются как неспецифические изменения, связанные с острым воспалением и выпотеванием белка. Микроскопические изменения в Печени не носят диагностического характера и мало коррелируют со степенью функционального повреждения органа. Проявляются они мутным набуханием паренхиматозных клеток, разрушением печеночных тяжей, расширением купферовских клеток и стазом желчи в желчных протоках. Изменения, выявляемые в ткани мозга и в мозговых оболочках, также минимальны и не имеют диагностического значения. Микроскопически выявляют признаки миокардита. В легких обнаруживают кровоизлияния, локализованные геморрагические пневмониты. При импрегнации серебром в просвете почечных канальцев удается выявить возбудитель, однако в других органах он обнаруживается редко.
Клинические проявления. Общие симптомы. Инкубационный период после заражения колеблется от 2 до 26 дней, как правило, составляет от 7 до 13 дней; в среднем — 10 дней.
Лептоспироз — заболевание с типичным двухфазным течением. Во время лептоспиремии, или первой фазы, возбудитель обнаруживается в крови и в цереброспинальной жидкости. Начало заболевания обычно внезапное и характеризуется головной болью, локализующейся, как правило, в лобных отделах, реже ретроорбитально, но иногда головная боль может носить двустороннюю височную локализацию или захватывать область затылка. У большинства больных наблюдаются тяжелые мышечные боли ноющего характера; в процесс обычно вовлекаются мышцы бедра и поясничной области, причем часто это сопровождается резкой болью при пальпации. Миалгия может сопровождаться чрезвычайно резко выраженной гиперестезией кожи (сильная жгучая боль). Весьма характерны ознобы, развивающиеся вслед за стремительным подъемом температуры тела. Лептоспиремическая фаза болезни, характеризующаяся описанными симптомами, продолжается от 4 до 9 дней. На протяжении этого периода отмечаются повторные ознобы, значительное повышение температуры тела (до 38,9°С и более), головные боли и сохраняющаяся тяжелая миалгия. У 50% больных наблюдаются потеря аппетита, тошнота и рвота. Иногда развивается диарея. Симптоматика со стороны легких, обычно проявляющаяся либо кашлем, либо болями в груди, непостоянна и может наблюдаться у 25—86% больных. Кровохарканье наблюдается реже. Известны случаи развития синдрома острой дыхательной недостаточности взрослых (дистресс-синдром). При физикальном обследовании больного в этот период отмечают остротекущий процесс с фебрильной температурой тела, относительной брадикардией и нормальным артериальным давлением. Нарушения чувствительности могут быть обнаружены не более чем в 25% случаев. В Китае у детей, больных лептоспирозом, описаны транзиторные приступы нарушения мозгового кровообращения (ишемия), обусловленные развитием лептоспирозного артериита.
Наиболее характерным физикальным признаком является кровоизлияние в конъюнктиву, которое обычно проявляется как первый признак уже на 3-й или 4-й день, хотя у некоторых больных может и отсутствовать. Оно может сочетаться с фотофобией, но редко сопровождается серозной или гнойной секрецией. К менее распространенным симптомам относятся гиперемия глотки, кровоизлияния в коже, кожные высыпания. Последние чаще всего располагаются на туловище и носят характер макулезных, макулопапулезных или напоминают крапивницу. В ряде случаев отмечают также спленомегалию, гепатомегалию, лимфаденопатию или желтуху: Первая фаза болезни заканчивается через 4—9 дней, при этом симптомы стихают или исчезают, что соответствует исчезновению лептоспир из крови и церебральной жидкости.
Вторая фаза заболевания характеризуется как иммунная и коррелирует с появлением циркулирующих антител IgM. Концентрация С3 в сыворотке крови во время этой фазы остается в пределах нормальных величин. В клинических проявлениях, наблюдаемых в это время, отмечается большее разнообразие, чем в предыдущую фазу. После относительно бессимптомного периода в течение первых 1—3 дней температура тела вновь повышается и появляются ранние симптомы, могут развиться явления менингизма. Температура тела резко превышает 38,9°С и сохраняется обычно от 1 до 3 дней. Нередко лихорадка отсутствует или носит транзиторный характер. Даже при отсутствии признаков раздражения мозговых оболочек рутинное исследование цереброспинальной жидкости после 7-го дня болезни выявляет плеоцитоз у 50—90% больных. Менее распространенными проявлениями второй фазы болезни являются иридоциклит, неврит зрительного нерва и другие изменения со стороны нервной системы, включая энцефалиты, миелиты и периферические невропатии.
Некоторые клиницисты выделяют третью фазу, или фазу конвалесценции, обычно между 2-й и 4-й неделями, когда и лихорадка, и ноющие боли могут рецидивировать. Патогенез этой стадии не ясен.
Во время беременности лептоспироз может быть фактором риска в отношении жизнеспособности плода.
Специфические признаки. Синдром Вейля. Синдром Вейля, который может быть. вызван возбудителем, не относящимся к серотипу Icterohemorragiae, — это тяжелое заболевание, характеризующееся желтухой, анемией, нарушениями сознания и продолжительной лихорадкой. В отношении патогенеза этого синдрома не установлено окончательно, является ли он результатом прямого токсического воздействия лептоспир или же последствием иммунной ответной реакции организма на антигены лептоспир. Гипотезу о токсическом воздействии можно рассматривать как более приемлемую.
Начало и первая стадия идентичны таковым при лептоспирозе менее тяжелых форм. Отличительные признаки синдрома Вейля проявляются на 3—6-й день, но максимальной выраженности они достигают в период второй стадии болезни. Как и при более легких формах лептоспироза, тенденция к затиханию симптоматики отмечается примерно к 7-му дню болезни, однако при развитии рецидива лихорадка приобретает выраженный характер и может персистировать на протяжении нескольких недель. Преобладают симптомы поражения либо почек, либо печени. При поражении печени отмечается болезненность в правом верхнем квадранте живота, увеличение размеров органа; эти симптомы наблюдаются также и при желтухе. Уровень глютамикощавелевокислой трансаминазы (ГЩТ) в сыворотке крови резко повышается более чем в 5 раз независимо от степени гипербилирубинемии, преимущественно конъюгированной (прямая). Например, уровень билирубина в сыворотке составляет 40 мг/дл, ГЩТ — 170 ME. Преобладающим механизмом, по всей вероятности, является внутриклеточный блок экскреции билирубина.
Изменения со стороны почек проявляются прежде всего протеинурией, пиурией, гематурией и азотемией. Дизурия наблюдается редко. Тяжелые поражения почек обычно проявляются в форме острого некроза канальцев, связанного с олигурией. Пиковый уровень азота мочевины в крови обычно наблюдается на 5—7-й день. В этой группе особенно часто наблюдаются носовые и желудочные кровотечения, кровохарканья, кровоизлияния в надпочечники, геморрагические пневмонии и субарахноидальные кровоизлияния. Эти осложнения объясняются наличием диффузных васкулитов с повреждением капилляров. Кроме того, у некоторых больных наблюдаются гипопротромбинемия и тромбоцитопения.
Асептический менингит. От 5 до 13% спорадических случаев асептических менингитов относят к заболеваниям лептоспирозной этиологии. При быстром прогрессировании болезни до начала иммунной фазы плеоцнтоз не обнаруживается. Количество лейкоцитов может доходить до 1•109/л с преобладанием нейтрофилов или мононуклеаров. Концентрация глюкозы в цереброспинальной жидкости почти всегда в пределах нормы, реже — понижена (гипогликорахия). В противоположность многим асептическим менингитам вирусной этиологии при лептоспирозе уровень белка в ЦСЖ может достигать 100 мг/дл на ранних сроках заболевания. Для больных с желтухой характерна ксантохромная окраска ЦСЖ. По всей вероятности, асептический менингит может вызвать любой из серотипов лептоспир, патогенных для человека. Наиболее часто ими являются Canicola, Icterohemorragiae и Pomona.
Претибиальная лихорадка (лихорадка форта Брегг). Заболевание наблюдалось летом 1942 г. и первоначальные симптомы его походили на таковые, характерные для первой фазы лептоспироза. Единственным отличительным признаком было появление приблизительно на 4-й день болезни сыпи в виде симметрично расположенных в области передних поверхностей голени эритематозных, слегка приподнятых очагов диаметром 2—5 см. В противоположность другим лептоспирозным синдромам у 95% больных наблюдали спленомегалию. Было установлено, что эта вспышка заболевания была вызвана серогруппой Autumnatis. В последующем обнаружили, что заболевания, вызываемые лептоспирами группы Pomona, также сопровождаются кожными высыпаниями, обычно расположенными на туловище, но возможна локализация и в области голени.
Миокардит. Лептоспироз сопровождается нарушением ритма сердца, включая пароксизмальную фибрилляцию предсердий, мерцание предсердий, желудочковую тахикардию и преждевременное сокращение желудочков, однако, как правило, эти проявления не имеют большого клинического значения. Значительно реже наблюдается расширение сердца с острой недостаточностью левого желудочка. Болезнь характеризуется также желтухой, инфильтративными изменениями в легких, артритами, кожной сыпью. Возбудитель относят к серотипам Icterohemorrhagiae, Pomona и Grippotyphosa.
Особенности проявления лептоспироза у детей. Описано несколько клинических проявлений болезни, которые свойственны лишь детям, или чрезвычайно редко наблюдаются у взрослых больных. К ним относятся повышение артериального давления, акалькулезный холецистит (у пяти из девяти детей из одной группы), панкреатит, абдоминальные каузалгический синдром и периферическая десквамация сыпи, характерная для гангрены или сердечно-легочной недостаточности. Такие признаки, как десквамация, вовлечение в процесс миокарда и водянка желчного пузыря, позволяют предположить наличие синдрома Кавасаки (см. гл. 49).
Лабораторные исследования. У больных без признаков желтухи количество лейкоцитов варьирует от уровня, характерного для лейкопении до небольшого повышения. У больных с желтухой количество лейкоцитов составляет около 70•109/л. Однако несмотря на общее количество лейкоцитов, во время первой фазы болезни часто отмечается нейтрофилия, превышающая 70%.
В культуре патогенных лептоспир обнаруживаются гемолитические субстанции. В противоположность гемолизинам бактериального происхождения, не обладающим гемолитическим действием in vivo, гемолизины лептоспир таким действием, по-видимому, обладают. Особая типичность течения болезни у лиц с желтухой и анемией в большинстве случаев обусловлена внутрисосудистым гемолизом. Другими причинами развития анемии являются развивающиеся вторично после кровотечения потеря крови и азотемия. У больных без желтухи анемия при лептоспирозе не наблюдается.
Может наблюдаться тромбоцитопения, по всей вероятности, обусловленная кровотечением (количество тромбоцитов менее 30•109/л). К числу дополнительных гематологических нарушений относится повышение СОЭ до 50 мм/ч, наблюдаемое более чем у 50% больных.
Исследование мочи во время лептоспиремической фазы болезни выявляет небольшую протеинурию, цилиндры и повышенное содержание клеточных элементов. В случае течения заболевания без развития желтухи эти изменения быстро, в течение недели, исчезают. Протеинурия и изменения в составе осадка мочи обычно не связаны с повышением в крови уровня азота мочевины. Так как безжелтушная форма заболевания часто остается недиагностированной, частота выявления азотемии при наличии желтухи оказывается довольно высокой. Азотемия обнаруживается примерно у 25% больных. У 75% из них содержание в крови азота мочевины составляет менее 100 мг/дл. Азотемия, как правило, сочетается с желтухой. Уровень сывороточного билирубина может достигать 65 мг/дл, однако у 60% таких больных он составляет менее 20 мг/дл. В течение первой фазы заболевания у 50% больных выявляется повышенный уровень креатининфосфокиназы, причем средний ее показатель в 5 раз превышает норму.
Это не характерно для вирусного гепатита, и при наличии у больного небольшого повышения уровня трансаминазы в сочетании с выраженным повышением уровня креатининфосфокиназы диагноз лептоспироза становится более вероятным, чем диагноз вирусного гепатита.
Диагностика. Диагностика основывается на результатах бактериологического или серологического исследований. При постановке диагноза у больного лептоспирозом наиболее часто возникает подозрение на менингит, гепатит, нефрит, лихорадку неясного происхождения, инфлюэнцу, синдром Кавасаки. токсический шоковый синдром, болезнь легионеров. Лептоспиры выделяются сравнительно легко из крови и цереброспинальной жидкости во время первой фазы болезни или из мочи во время второй фазы. Лептоспиры выделяются с мочой в течение 11 мес с момента начала заболевания и могут персистировать в организме, несмотря на антимикробную терапию. Для выделения лептоспир цельную кровь следует немедленно засевать в пробирки, содержащие полужидкую среду, например среду Флетчера или среду EMJH. Если в распоряжении исследователя нет подходящей среды для посева, необходимо иметь в виду, что .в крови, к которой добавлен антикоагулянт (предпочтительно оксалат натрия), лептоспиры сохраняют жизнеспособность до 11 дней. Для выделения возбудителя можно воспользоваться также биологическим методом (заражение животных, предпочтительнее сосунков хомяков или морских свинок); этот метод приобретает особую ценность, если исследуемый материал сильно загрязнен. Применяется также прямое исследование крови или мочи в темном поле зрения, однако этот метод настолько часто дает отрицательные или ошибочные результаты, что пользоваться им не следует. Во второй фазе заболевания применимы серологические методы исследования, так как антитела появляются с 6—12-го дня заболевания. Чаще всего применяются две реакции: реакция макроскопической агглютинации, или агглютинации на стекле, которая легко выполнима, но отличается низкой специфичностью и чувствительностью, а поэтому может использоваться только для скрининга, и реакция микроскопической агглютинации, более сложная в постановке, но в то же время и более специфичная. Серологическим критерием диагноза является нарастание титра антител в течение болезни в 4 и более раз. В процессе реакции агглютинации обычно наблюдаются перекрестное реагирование между различными серотипами возбудителя, в связи с чем определить серотип без выделения возбудителя не представляется возможным.
Прогноз. Прогноз заболевания зависит как от вирулентности возбудителя, так и от общего состояния больного. В период с 1974 по 1981 г. в США смертность при зарегистрированных случаях болезни колебалась от 2,5 до 16,4% в год, составляя в среднем 7,1%. Наиболее важным фактором со стороны макроорганизма, влияющим на показатель уровня смертности, является возраст больного. В репрезентативных сериях исследований уровень смертности возрастает с 10% среди мужчин в возрасте моложе 50 лет до 56% среди мужчин более старшего возраста. Вирулентность возбудителя более всего коррелирует с развитием желтухи. Среди больных, у которых лептоспироз протекает без желтухи, смертельные исходы наблюдаются очень редко, но при развитии желтухи смертность колеблется от 15 до 48%. Отдаленный прогноз после острого поражения почек при лептоспирозе благоприятный. Скорость клубочковой фильтрации обычно восстанавливается до нормы в течение 2 мес, однако у некоторых больных отмечается остаточная дисфункция канальцев, в частности дефект концентрационной способности.
Лечение. Целый ряд антимикробных препаратов, включая пенициллин, стрептомицин, производные тетрациклина, левомицетин и эритромицин, эффективны in vitro и при экспериментальной лептоспирозной инфекции. Данные относительно эффективности антибиотиков у людей противоречивы. Для того чтобы противомикробные препараты оказали выраженный эффект, они должны быть применены в первые 4 дня от начала заболевания. В течение первых 4—б ч после начала лечения пенициллином G может развиться реакция Яриша—Герсгеймера, которая предположительно указывает на наличие у пенициллина противолептоспирозной активности. Клинические исследования показали, высокую, эффективность доксициклина как профилактического средства в дозе 200 мг перорально 1 раз в неделю. Более того, доксициклин (100 мг перорально 2 раза в день в течение 7 дней) при условии применения его в первые 4 дня от начала заболевания способствует значительному сокращению продолжительности лихорадочного периода и большинства другие симптомов, а также существенно снижает частоту развития лептоспирурии. Оба исследования были выполнены у больных, заболевших в Панаме. Как правило, эпидемиологические условия и клинические проявления заболевания при лептоспирозе типичны. Поэтому можно полагать, что сделанные на основании этих исследований выводы применимы и к другим областям, а также могут быть распространены и на препараты группы тетрациклина при условии использования их в соответствующих дозах. Существует общее мнение, что антимикробные препараты, примененные после 5-го дня болезни, не оказывают благоприятного воздействия. В клинике существует мнение, что уменьшению болезненных проявлений может способствовать своевременно (как можно раньше) назначенный постельный режим. При наличии азотемии и желтухи необходимо поддерживать жидкостный и электролитный баланс в организме. Так как развивающиеся при лептоспирозе повреждения почек обратимы, больные с азотемией могут получать лечение с помощью перитонеального диализа или гемодиализа. Из опубликованных сообщений можно предположить, что благоприятное влияние при лечении больных с резко выраженной гипербилирубинемией могут оказывать обменные трансфузии.
Дата добавления: 2015-07-22; просмотров: 1195;
