Протеинурия
Здоровый взрослый человек в сутки выделяет до 150 мг белка, причем из них только 10—15 мг приходится на альбумин. Остальное количество представлено 30 разными белками плазмы и гликопротеинами — продуктами деятельности почечных клеток. Среди белков, содержащихся в моче, превалирует мукопротеин Тамма—Хорсфолла. Его происхождение связано не с плазмой, а с клетками восходящего колена петли нефрона (Генле). Скорость его экскреции составляет 25 мг/сут. Ежесуточная экскреция белка с мочой в количестве более 150 мг, строго говоря, носит название патологической протеинурии, но на практике обычно пользуются простым термином «протеинурия». Экскрецию белка более 3,5 г/сут называют массивной протеинурией. Она, как правило, встречается в том случае, когда почечные клубочки настолько повреждены, что белки плазмы, особенно альбумин, могут свободно переходить в мочу. Потеря альбумина с мочой вызывает снижение концентрации белка в сыворотке. Следующее за этим уменьшение внутрикапиллярного онкотического давления способствует развитию тканевого отека (см. гл. 28). В сыворотке увеличивается концентрация липидов (о причинах см. в гл. 223). Совокупность массивной протеинурии, гипоальбуминемии, отека и гиперлипидемии часто называют нефротическим синдромом. Вместе с тем, этот термин используют в качестве синонима для обозначения состояния, при котором определяют один-единственный симптом — массивную потерю белка с мочой. Гипоальбуминемия, увеличенное количество липидов в крови и отек относятся к патофизиологическим последствиям массивной протеинурии и встречаются, когда синтез альбумина в печени, будь он в пределах нормы или даже повышен, не может компенсировать потерю с мочой указанного белка Перечисленные нарушения принято считать косвенным результатом заболевания почек.
Определение протеинурии. Протеинурию обычно диагностируют с помощью мочевых индикаторных палочек. Минимальная концентрация белка, обнаруживаемая с их помощью, составляет 50 мг/л. Четкое изменение цвета индикатора на одну градацию видно при содержании белка в моче, примерно равном 300 мг/л. Если моча очень разбавлена, то протеинурию легко не заметить. В связи с этим обычно исследуют утренние (наиболее концентрированные) порции мочи, полученные натощак. Индикаторы наиболее чувствительны к альбумину. В связи с этим можно получить отрицательный результат в тех случаях, когда в моче содержится много белка, но другого вида, или когда с мочой выделяются белковые фрагменты в. виде легких пептидных цепей. .Выявленная с помощью индикаторов протеинурия нуждается в дополнительном подтверждении путем измерения суточного количества белка в моче. Если эта величина превышает норму, тогда целесообразно определить соотношение альбумина и глобулинов, применив электрофоретическое разделение белков на ацетате целлюлозы или другие методы. Если моноклональный пик при обычном электрофорезе мочи заставляет думать о присутствии фрагментов иммуноглобулина (легкие - и -цепи), то для идентификации необходим иммуноэлектрофорез.
Механизмы развития протеинурии. Канальцевая протеинурия. В норме низкомолекулярные [относительная молекулярная масса (ОММ) не менее 40000] сывороточные белки, например 2-микроглобулин (ОММ—11600), лизоцим (ОММ— 14000), или короткие цепи белков (ОММ 22000) легко фильтруются в почечных клубочках, но в то же время настолько эффективно реабсорбируют, что с мочой выводится лишь ничтожное их количество. Заболевания, при которых избирательно повреждаются в большей степени трубочки, а не клубочки (см. гл. 226), вызывают чрезмерную экскрецию перечисленных мелких молекул белка. При этом экскреция альбумина либо совсем не увеличивается, либо если и увеличивается, то ненамного. Результирующая протеинурия обычно составляет 1—3 г/сут. Однако отека и липидных нарушений не возникает, так как потери альбумина малы. Следствием патологического процесса может быть повышение в плазме уровня протеинов, например миоглобина, белка Бенс-Джонса (предположительно димер, состоящий из двух легких цепей) и собственно самих легких цепей. Если фильтрационная нагрузка в клубочках превышает реабсорбционную способность канальцев, то может возникнуть состояние так называемой переполненной протеинурии.
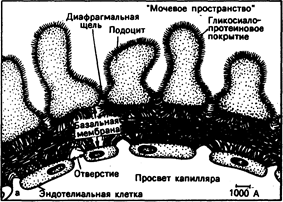
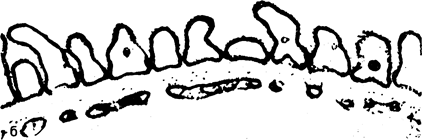
Рис. 40.1. Схематическое изображение структур, разделяющих просвет капилляра и «мочевого пространства» клубочка (а).
В процессе клубочковой фильтрации ультрафильтрат плазмы проникает через стенку клубочкового капилляра по отверстиям между эндотелиальными клетками, базальной мембране и диафрагмальным . щелям. Как полагают, переход макромолекул плазмы ограничивается каждой из этих структур. Кроме того, циркулирующие в крови полианионы (например, альбумин) задерживаются, вероятно, отрицательно заряженными гликосиалопротеинами, распределяющимися по всей стенке клубочка (затемненная область); б— электронная микрофотография тех же структур. (Представлено N. L. Gahan с разрешения В. М. Brenner, R. Becuwkes.—Hosp. Proc., 1978, Vol. 13, N7).
Клубочковая протеинурия. В норме альбумин или глобулин фильтруются через почечные клубочки в очень небольших количествах. Эндотелиальные клетки клубочковых капилляров образуют барьер с порами диаметром около 100 нм. Он задерживает клетки и другие частицы, но большинство белков проходит через него. Базальная мембрана препятствует прохождению молекул с эффективным диаметром около 5 нм, т.е. молекул с ОММ более 100000. Поверхность базальной мембраны клубочка, контактирующей с мочой, покрыта отростками висцеральных клеток эпителия (подоциты). Отростки образуют многочисленные узкие каналы, через которые молекулам, пересекающим базальную мембрану, предстоит пройти (рис. 40-1). Отрицательно заряженные молекулы, например альбумин, фильтруются с большим трудом, чем нейтральные или положительно заряженные молекулы того же размера, в связи с чем альбумин поступает в фильтрат в небольшом количестве. Этот избирательный эффект, по-видимому, обусловлен действием отрицательно заряженных гликопротеинов, выстилающих поверхность отростков подоцитов и влияющих на структуру матрикса базальной мембраны (см. гл. 218). Отрицательный заряд гликопротеинов обусловлен присутствием в их молекуле дикарбоксильных аминокислот, а также глутаминовой, аспартатовой и сиаловой кислот. При рН крови 7,4 или рН мочи 4,5—7,5 карбоксильные и сиаловые остатки кислот диссоциируют, создавая таким образом отрицательный заряд. Альбумин в целом тоже отрицательно заряжен. В результате отрицательно заряженные участки гликопротеинов отталкивают отрицательно заряженные участки альбумина, чем и затрудняют фильтрацию последнего.
При болезни почечных клубочков могут разрушиться эти фильтрационные барьеры. Поражение, ограниченное рамками только полианионных гликопротеинов (молекулы с несколькими отрицательно заряженными участками. — Примеч. пер.), будет скорее всего сопровождаться избирательной потерей с мочой отрицательно заряженных белков, например альбумина, который из-за своего заряда в норме почти не фильтруется в клубочке. Обширное поражение, распространяющееся на всю базальную мембрану клубочков, а не только на полианионные структуры, способно привести к потере наряду с альбумином и других очень крупных по размерам белков.
Селективность протеинурии варьирует в зависимости от обширности поражения почечного клубочка. Однако клиническая ценность измерения этой селективности полностью еще не определена. Суть подобных измерений состоит в установлении части теоретически максимальной фильтрационной нагрузки, которую составляет скорость экскреции белка, равная произведению его концентрации в сыворотке на скорость клубочковой фильтрации. Полученная величина должна отражать эффективность фильтрации белка по отношению к полностью фильтруемому индикатору, применяемому для определения СКФ при условии, что канальцевая реабсорбция и катаболизм почечного белка ничтожны. В качестве индикатора обычно используют инулин или креатинин. Наклон линии графика зависимости соотношения клиренса от ОММ различных сывороточных белков представляет собой показатель избирательной фильтрации. Более практичный вариант этого теста основан на анализе соотношения клиренса двух белков с различной ОММ, таких как IgG и трансферрин (см. гл. 223).
Обследование больного с протеинурией. В тех случаях, когда уровень протеинурии по индикатору равен одной градации или более, следует измерить суточную экскрецию белка с мочой. Если суточная экскреция превышает 150 мг, то для определения соотношения в моче альбумина и других белков нужен электрофорез. Экскреция преимущественно глобулина указывает на поражение почечных клубочков. Суточная экскреция белка более.3,5 г характерна для нефротического синдрома. Менее выраженную альбуминурию называют скрытым нарушением функции почек. Начальная последовательность приемов для оценки протеинурии представлена в общих чертах в гл. 217. Дальнейшие подробности дифференциальной диагностики приведены в гл. 223 и 224. Канальцевая протеинурия обычно свидетельствует о врожденной или приобретенной патологии канальцев (см. гл. 228) или о тубулоинтерстициальной нефропатии (см. гл. 226). При большом количестве белка Бенс-Джонса в моче можно думать о множественной миеломе (см. гл. 258).
Дата добавления: 2015-07-22; просмотров: 975;
