ЭЛЕКТРОД. СТАНДАРНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Электрод – это металл или другой токопроводящий материал, погруженный в раствор или расплав электролита. Например, цинковая пластина, опущенная в водный раствор сульфата цинка ZnSO4, или медная, - в водный раствор CuSO4 , платина, погруженная в раствор поваренной соли и др.
На границе металл-электролит, изображаемой Ме|раствор, возникает разность потенциалов. В частном случае электродов 1-го рода, металл и раствор содержат одинаковые ионы - катионы металла. В металле катионы находятся в узлах кристаллической решетки, а между ними перемещаются свободные электроны, полностью компенсирующие заряд катионов. В растворе ионы металла гидратированы - связаны с молекулами воды.
а б
Рис.1 двойной электрический слой: а) металл заряжен положительно,
б) – отрицательно
При погружении металлической пластины в раствор ионы металла, расположенные в поверхностном слое, притягивают полярные молекулы воды, вырываются ими из кристаллической решетки и, гидратированные, переходят в раствор. Одновременно под действием сил кристаллической решетки происходит обратный процесс. В зависимости от природы металла и концентрации раствора в момент погружения металла в раствор скорость одного из этих процессов больше, на границе металл-раствор его соли устанавливается равновесие:
Me + m H2O ↔Men+∙ mH2O + nē, (1)
где Me – атом металла, Men+∙ mH2O – гидратированный ион металла в растворе, n- число электронов ( совпадает с величиной заряда иона).
В зависимости от природы металла и концентрации раствора количество катионов, переходящих из металла в раствор, может быть больше или меньше, чем количество катионов, вошедших в кристаллическую решетку. В первом случае создается избыток электронов в металле. Для активных металлов (например, цинк) количество перешедших катионов в раствор больше, чем вошедших в кристаллическую решетку, что создает избыток электронов в металле. Таким образом, металл заряжается отрицательно и притягивает к себе из раствора положительные ионы. На границе металл – раствор образуется так называемый двойной электрический слой (ДЭС). ДЭС можно уподобить плоскому электрическому конденсатору, одной из пластин которого является поверхность металла, другой – раствор электролита (рис.1).
Вследствие разделения зарядов в ДЭС между металлом и раствором возникает разность электрических потенциалов, которая не поддается измерению, называется электродным потенциалом. Потенциал, соответствующий состоянию равновесия на поверхности электрода, называется равновесным.
Для измерения равновесного потенциала создается гальванический элемент – система из двух электродов.
За равновесный (стандартный) электродный потенциал электрода (Е0Ox/Red) принимают ЭДС гальванического элемента, составленного из стандартного водородного электрода и данного электрода.
Величина электродного потенциала зависит от химической природы металла, концентрации ионов в растворе, температуры и числа электронов, принимающих участие в электродном процессе.
Зависимость равновесного электродного потенциала от указанных выше факторов определяется уравнением Нернста:
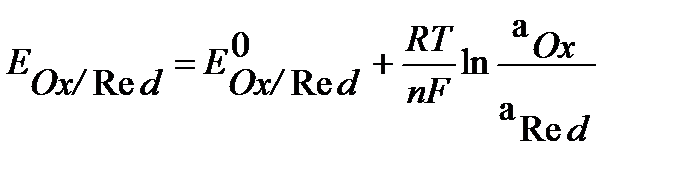 , (2)
, (2)
где E0Ox/Red – равновесный (стандартный) электродный потенциал, В;
n – количество эквивалентов металла, совпадающее с числом электронов, участвующих в электродном процессе;
R = 8,31 Дж/моль•К – универсальная газовая постоянная;
Т – температура, К;
F = 96500 Кл/моль – постоянная Фарадея;
aOx , aRed – активность окисленной и восстановленной формы в растворе соответственно, моль/л. Для разбавленных растворов активность совпадает с молярной концентрацией а=С;
При стандартных условиях (Т= 298К), с учетом численных значений R и F, а также при замене натурального логарифма десятичным, уравнение Нернста принимает вид
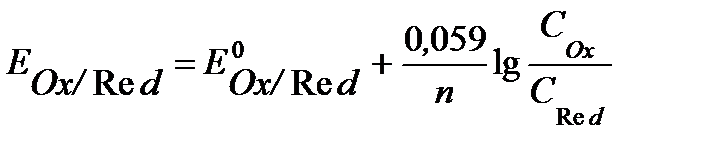 , (3)
, (3)
где СOx, CRed -концентрация окисленной и восстановленной формы в растворе соотвественно, моль/л.
КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ
Электроды I-го рода. К электродам I-го рода относятся металлические, окислительно-восстановительные (редокс-) и газовые электроды .
Металлические электроды описаны выше. Это металл, погруженный в раствор собственной соли, не является инертным, а участвует в электродной реакции. Уравнение Нернста для металлических электродов имеет вид:
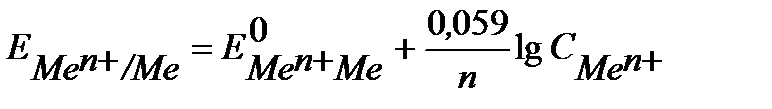 , (4)
, (4)
где 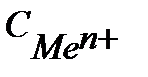 - концентрация ионов металла в растворе, моль/л.
- концентрация ионов металла в растворе, моль/л.
Окислительно-восстановительные редокс-электроды – это электроды из инертного металла, играющего роль токоподвода, на поверхности которого протекает окислительно-восстановительная реакция. Например: Fe3+ + ē ↔ Fe2+
Уравнение Нернста для редокс - систем включает концентрацию обоих катионов и имеет вид:
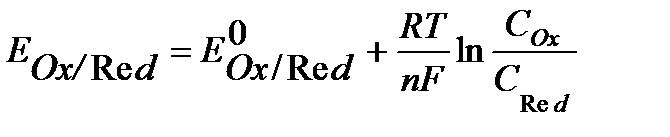 , (5)
, (5)
где СOx, CRed– концентрации окисленной и восстановленной формы соответственно, моль/л.
К газовым электродам относят электроды, у которых окисленная или восставленная форма находится в газообразном состоянии. Представителями газовых электродов являются водородный, кислородный, хлорный и другие электроды.
Водородный электрод. Водородный электрод состоит из платиновой проволоки, покрытой платиновой чернью (электролитически осажденной платиной) и погруженной в раствор кислоты (рис.2). Через раствор непрерывно пропускается поток водорода, водород «растворяется» на поверхности платины и на границе электрод / раствор устанавливается равновесие:
H+(раствор) + ē ↔ ½ H2 (г) . (6)
Уравнение Нернста для водородного электрода имеет вид:
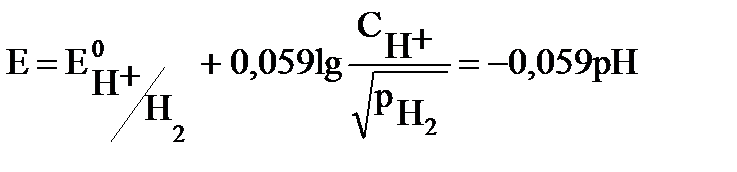 ,
,
где  - стандартный электродный потенциал,
- стандартный электродный потенциал,
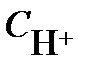 - концентрация ионов водорода в растворе, моль/л
- концентрация ионов водорода в растворе, моль/л
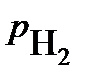 -парциальное давление водорода над раствором, атм.
-парциальное давление водорода над раствором, атм.
При давлении водорода, равном 105Па (1 атм), активности (концентрации) ионов водорода СН+ =1 моль/л и Т=298К водородный электрод называется стандартным водородным электродом.
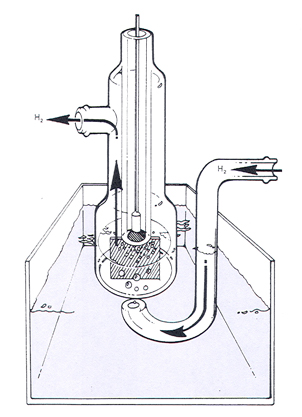
Рис. 2. Стандартный водородный электрод
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ. СХЕМА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА. ТОКООБРАЗУЮЩАЯ РЕАКЦИЯ.
ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
Гальванический элемент – это система, состоящая из двух электродов, в которой за счет окислительно-восстановительных реакций между электродами возникает разность потенциалов.
Электрод с меньшим значением потенциала заряжается отрицательно, является анодом. Электрод с большим значением потенциала заряжается положительно, является катодом. На аноде протекает процесс окисления (отдача электронов), на катоде – процесс восстановления (присоединение электронов).
Гальванические элементы принято записывать в виде схем. Анод со знаком (-) записывают слева, катод со знаком (+) записывают справа. Границу раздела обозначают вертикальной чертой. Например, схема медно-цинкового гальванического элемента Даниэля-Якоби может быть представлена таким образом:
(-)Zn|ZnSO4||CuSO4|Cu(+) или (-)Zn|Zn2+||Cu2+|Cu(+)
Одна вертикальная черта на схеме обозначает границу между металлом и раствором электролита, две черты – границу между растворами.
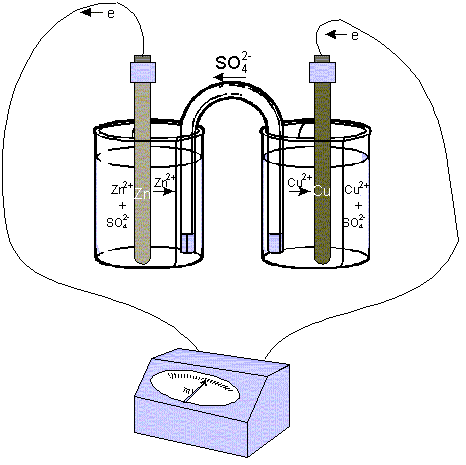
Рис. 3. Схема гальванического элемента Даниэля-Якоби
Гальванический элемент Даниэля-Якоби представляет собой: цинковую и медную пластину опущенные в 1М растворы своих солей, соединенные электролитическим мостиком. При замыкании цепи электроны по внешней цепи пойдут от анода к катоду – от цинка к меди. При этом на электродах протекают следующие реакции:
Анодный процесс Zn – 2e→ Zn2+ реакция окисления
Катодный процесс Cu2+ + 2e →Cu реакция восстановления
Суммируя процессы на катоде и аноде, получаем уравнение окислительно-восстановительной реакции, за счет которой в гальваническом элементе возникает электрический ток:
Zn + Cu2+ = Zn2+ + Cu
Такое уравнение называется – уравнением токообразующей реакции.
ЭДС гальванического элемента рассчитывают как разность потенциалов катода и анода: Е = Ек – Еа.
ЭДС медно-цинкового элемента 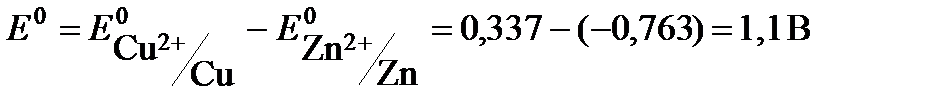 .
.
В гальваническом элементе электрический ток возникает за счет химической реакции, т.е. химическая энергия в элементе превращается в электрическую.
При обратимом изотермо- изобарическом процессе (Т= const, р = const) получаемая электрическая энергия будет наибольшей, а совершаемая системой работа будет иметь максимальное значение, равное убыли энергии Гиббса:
 (7)
(7)
ЭЛЕКТРОЛИЗ. ЗАКОНЫ ФАРАДЕЯ.
Окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока от внешнего источника через раствор или расплав электролита, носит название электролиза.
Электролиз проводят в электролизерах или электролитических ваннах, заполненных раствором или расплавом электролита.
Электрод, подсоединенный к отрицательному полюсу внешнего источника тока, называется катодом. На катоде протекают процессы восстановления частиц электролита.
Электрод, подключенный к положительному полюсу источника тока, называется анодом. На аноде протекают процессы окисления частиц электролита или материала электрода.
Последовательность процессов, протекающих на электродах, определяются свойствами электролита, растворителя и материала электрода. Какие именно процессы будут протекать, прежде всего зависит от соотношения электродных потенциалов соответствующих реакций. Из нескольких альтернативных процессов протекает тот, осуществление которого требует минимальных затрат энергии. Это означает, что на катоде в первую очередь протекают реакции с наибольшим значением электродного потенциала, а на аноде - с наименьшим.
Рассматривая процессы электролиза водных растворов, необходимо учитывать возможность участия молекул воды в электродных реакциях: восстановления на катоде (8) и окисления на аноде(9).
На катоде: 2H2O + 2e → H2 + 2 OH- (8)
На аноде: 2H2O – 4 e 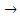 O2 + 4 H+ (9)
O2 + 4 H+ (9)
Анодные процессы зависят от природы электролита и материала анода. В связи с этим различают электролиз с инертным и растворимым анодом.
Инертным (нерастворимым) называется анод, материал которого не окисляется в процессе электролиза. К инертным относятся графитовый, угольный, платиновый и др. электроды.
Растворимым является анод, материал которого окисляется при прохождении тока. Большинство металлических электродов являются растворимыми. В случае растворимого анода, кроме окисления аниона электролита и молекул воды, возможна реакция окисления материала анода.
Напряжение электролиза. Напряжение электролиза (ΔUэл-за) – это разность потенциалов, необходимая для протекания реакций на катоде и аноде.
ΔUэл-за = iEа – iEк + ΔUэл-та + iR , (10)
где iEа ,iEк - потенциалы анода и катода под током соответственно, ΔUэл-та , iR – падение напряжения при прохождении тока через электролит и внешнюю цепь соответственно.
Электролиз процесс неравновесный, поэтому потенциалы электродных реакций под током отличаются от своих равновесных значений на величину ΔЕа и ΔЕк .
iEа = рEа + ΔЕа, iEк = рEк + ΔЕк. (11)
Смещение потенциала электрода от его равновесного значения под влиянием внешнего тока называется электродной поляризацией. Величина поляризации (ΔЕа и ΔЕк) называется перенапряжением.
Сравнение равновесных потенциалов конкурирующих электродных реакций может служить только ориентировочным критерием оценки последовательности разряда частиц при электролизе. Прохождение тока нарушает равновесие, существующее на электродах.
Большинство процессов на электродах идут с перенапряжением. На величину перенапряжения влияют многие факторы: природа материала электрода, условия проведения электролиза (плотность тока, температура) и др. Для правильного выбора процессов на электродах необходимо сравнивать не величины равновесных потенциалов возможных полуреакций, а величины потенциалов поляризованных электродов.
Процесс образования газов, как правило, протекает с перенапряжением. Рассмотрим процесс электролиза водного раствора хлорида на инертном электроде. На аноде возможны следующие реакции:
2 Cl- - 2 e → Cl2 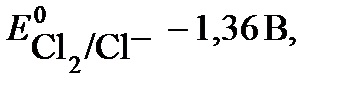
2H2O – 4 e  O2 + 4 H+
O2 + 4 H+ 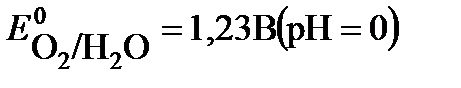
Потенциал окисления воды дан для кислого раствора (рН=0), с учетом подкисления раствора при электролизе.
Согласно величинам стандартных электродных потенциалов на аноде должен выделяться кислород. В действительности на электроде выделяется хлор. Величина перенапряжения зависит от материала, из которого изготовлен электрод. Для графита перенапряжение кислорода составляет 1,17 В при плотности тока = 1а/м2, что повышает потенциал окисления воды до 2,4 В.
Дата добавления: 2015-07-22; просмотров: 2866;
