Пенициллиндер
Сонымен, А. Флеминг зең саңырауқұлағымен ластанған ыдысты жуатын ыдыстар арасына тастамады. Ол зең саңырауқұлағын жаңа тығыз қоректік ортасына қайта егіп 4-5 тәулікке бөлме температурасында қалдырды. Зеңнің үлкен колониясы өсіп шыққанда Флеминг колония айналасына бактериялық дақылды егті. Ғалымның байқағаны, бір тәулік инкубация жасаған кейн кейбір бактериялар көршілік түрде өсіп шыққан, ал басқаларының тіршілігі тежелгені анықталды. Зең саңырауқұлағы стрептококктарға, стафилококктарға, дифтерия коринебактериясына, сібір түйнеме бацилласына жоюшы болып келді. Зеңді сұйық қоректік ортада өсіргенде де фильтратта антимикробтық активтілік қабілеті анықталды. Флеминг дақылға сынақтар жасауда келесі мәселелерге өсудің қай күні, қандай температурада және қандай қоректік ортасында зеңнің бастапқы әсер етуінен бастап антимикробтық нәтижеге ие болғаны туралы шешім іздеді. Осы заттың маңызды қасиеті – бұл улылығы аса төмен болуы. Флеминг ор көжектер венасына 200 мл сұйықтықтар енгізу барысында көзі жеткені, осы инъекция микробтар өсірілмеген сұйық қоректік орта инъекциясы секілді қауіпсіз болып шықты. 1929 жылдың 13 ақпанында А. Флеминг медициналық ғылыми-зерттеу клубында (ұжымында) пенициллин туралы өзінің мәліметтерін баяндады. Аудитория баяндамаға қарама-қайшылықты (скепсисті)назар аударды, себебі зерттеулер кәдімгі шағын зертханада жүргізілуі және арнайы мамандырылған микологтың болмауынан. А. Флеминг өз зерттеулеріне берік болғандықтан сол жылы «Британский журнал экспериментальной патологии» атты журналдың 10-шы томына зерттеулер қорытындысы туралы мақала жазды, ашылған затты «пенициллин» деп атады.
Келешекте пенициллинді бөліп алуы және тазартуына зерттеулерді 1932 жылы Англияның атақты химигі профессор Г. Райстрик жетекшісімен жалғастырылды. Дегенмен химиктер пенициллиннің алғашқы тазартуынан абсолютті тазартылған түрін алу сынақтарын тоқтатты, себебі химиялық реакцияларда пенициллин жылдам ыдырай бастаған.
Тазартылған пенициллиннің тұрақты формасын Оскфорд университетінің химиктері Г. Флори, Э. Чейн және Н. Хитли тапты. 1941 жылының 12 ақпанында пенициллинді қанның ауыр стафилококктық инфекциясы дамыған бірінші пациентке сынақ жасалынды (оксфорд полицейскийге). Пенициллиннің бірнеше вена ішілік инъекциясы жуырда өлім күйінде болған науқастың жағдайы жақсара бастады, дене температурасы қалпына келді. Бірақ, зертхана жағдайында дақылдандырылған өндіруші штамынан алынған тазартылған пенициллин көлемі науқасты әрі қарай емдеуіне жетпеді, науқас адам бірнеше тәулік ішінде стафилококктық сепсис қайтадан дамуынан қайтыс болды.
Пенициллиндер – P.notatum, P.chrysogenum, P. crustosum және т.б. мицеллалы саңырауқұлақтардың екіншілік метаболиттері. Пенициллин N және цефалоспорин С актиномицеттерде синтездеялады. Сонымен қатар, цефалоспорин тәрізді антибиотиктер түзу қабілеті топырақтағы түрлі грам теріс бактерияларда анықталған.
Пенициллин құрылымы трипептид-LLD деп аталатын аминқышқылдар бастауышынан өндіріледі (L-аминоадипин қышқылы, L-цистеин және L-валин). Олигомеризация синтетаза-ферменттердің қатысуымен тиоматрицалық механизм бойынша атқарылады. Келесі кезеңдерде LLD-үшпептиді бета-лактамды сақинасына енеді, әрі қарай тиазолидин сақинасы түзіледі. Циклдеу үрдісі изопенициллин-N-синтетаза ферментімен катализденеді. Бұл пенициллин N және цефалоспорин S соңғы жалпы аралық өнімі болып келеді. Әрі қарай саңырауқұлақтарда изопенициллин N пенициллин G ауыстырылады, ал актиномицеттерде – пенициллин N-ға. Пенициллин G (бензилпенициллин) синтезіне фенилсіркесу қышқылы қатысады, нәтижесінде аминоадипин қышқылы ажыратылуы тиісті. Сонымен пенициллин биосинтезінің метаболизм жолы және біріншілік клетка метаболитіне – лизинге де жалпы бастауышы - бета-кетоадипин қышқылынан басталады. Дақылдандыру ортасында лизин деңгейі жоғарлауы гомоцитратсинтетаза – пенициллин синтезі метаболизм жолдарының бастауыш ферментінің активтілігі тежелуі байқалады, яғни антибиотик өнімі шығысы да төмендейді (ретроингибирлеу механизмі). Ал егер дақылдық ортаға бета-аминоадипин қышқылы қосылса, керісінше, пенициллин синтезі белсенеді.
Пенициллиннің әсер ету механизмі микробтың клетка қабырғасы пептидогликанына қажетті көлденең байланысын түзуіне маңызды микробтың мурамоилпентапептидкарбокси-пептидаза (МПП) ферментің тежеуге негізделген. Антибиотиктің құрылысы осы фермент субстратына үйлестік болып келеді (D-Ala-D-Ala-ның С-соңғысы бар пептид). Ол МПП ферментінің активті орталығында қайтымды байланысады. Сондықтан, бета-лактамды сақина сериннің активті қалдығы жаңында орналасады. Кейін нуклеофильді алмастыру активті орталыққа тосқауыл қоятындай фермент пен ингибитор арасында тығыс ковалентті байланыс орнатуына ықпал жасайды. Ферменттің активтілігі жойылуы өзгерген клетка қабырғасы пайда болуына және бөлініп жатқан бактериялар жойылуына жол ашады (сур. 52).
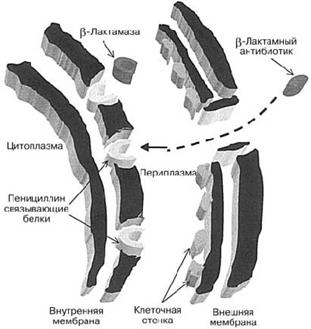 бета-лактамаза бета-лактамды антибиотик цитоплазма периплазма пенициллинді байланыстыратын протеиндер ішкі мембрана клетка қабаты сыртқы мембрана
бета-лактамаза бета-лактамды антибиотик цитоплазма периплазма пенициллинді байланыстыратын протеиндер ішкі мембрана клетка қабаты сыртқы мембрана
Сурет 52. Грам теріс бактериялар клеткаларындағы нысанамен бета-лактамды антибиотиктің өзара байланысы.
Пенициллинді улы емес деп айтуға болады. Экспериментте жануарларға терапиялық және токсикалық дозасының қатынасы 1:80000 құрайды. Түрлі инфекцияларда қолданылады, бұлшықетке, вена ішіне енгізеді. Препараттың инъекциясына кей жағдайда аллергиялық реакция туындайды.
Пенициллиннің клиникалық практикада қолдануына жиырма жыл өткенде дизентерия таяқшалар арасында оған төзімді штамдары табылған. Осындай микроорганизмдер пенициллиназа (беталактамаза) индуцибельді фермент түзімен антибиотиктің бета-лактамды сақинасын, «ядросың», яғни 6-аминопенициллан қышқылын (6-АПҚ) бұзады.
Келесі зерттеулерінде белгілі болғандай, егер 6-АПҚ бөліп алып химиялық реакцияларда оның бүйір топтарын өзгертсе, микробтық пенициллиназа ферменті осындай қосылысты ыдырата алмайды. Сонымен беталактамазаға төзімді өзгеше антибактериялық әсер ету спектрлі жартылай синтетикалық пенициллиндер мен цефалоспориндердің үлкен масштабты өндірісі басталды. Жартылай синтетикалық тәсілдің негізінде микробиологиялық синтезбен алынған пенициллин мен цефалоспоринге химиялық синтез көмегімен 6-АПҚ бір бүйірі басқаға ауыстырылуы жатады. Цефалоспоринде екі бүйір тізбегі ауыстырылады. Бұл жерде модификация үшін (пенициллин аналогиясы бойынша) құрылым ретінде цефалоспоринС қолданылады.
Пенициллин биосинтезі технологиясы
Пенициллинді тереңдік дақылдандыру әдісімен алады. Пенициллиннің қарқынды синтезі P.chrysogenum өндірістік штамының мицелла-биомассасының үлкен көлемде жинақтаумен басталады. Мысалы, пенициллин өндірісіне арналған қоректік орта құрамына глюкоза - 1,5%, лактоза - 5% (лактоза глюкозаның катаболизмдік репрессиясын алып тастайды), аммония сульфат және фосфаттар - 0,5-1%, жүгері экстрактісі - 2-3%, антибиотиктердің бастауыштары - фенокси- немесе фенилсіркесу қышқылы кіреді.
Ферментацияға дайындық : алғашында флакондарда 25-270 С 4-5 тәулік бойы споралар көбейеді. Бөлінген споралық материалды инокуляторларға себеді және әрі қарай себу аппаратарына – шағын көлемді биореакторларға (12-18 сағатқа вегетативті клеткалар өнуі үшін) себеді. Кейін субстратқа зең саңырауқұлағының өнген спораларын себеді. Кезеңдік ферментация 23-260 С, орта рН 5,0-7,5, аэрация жылдамдығы ортаның 1 м3 1 минутта ауаның 1 м3 көлемі түсуі керек; ферментация ұзақтығы – 4 тәулік.
Орта рН тұрақтандыру үшін буфер ерітінділері қолданылады, көбікті механикалық және химиялық тәсілдермен басады. Басқа микрофлорамен, бактериофагтармен ластандырмау үшін асептикалық жағдай мұқият сақталыу тиіс.
Ферментация аяқталғанда қоюланған дақылдық сұйықтықты сүзгіден өткізеді, пенициллині бар клеткаларды, саңырауқұлақ мицеллаларын сұйықтықтан ажыратылады. Фильтраттан нәруызды алюминий, темір тұздарымен бөліп алады немесе 65-700С коагуляция жасайды. Пенициллинді рН 1,9-2,0 органикалық ерітінділермен экстракциялайды (бутилацетат, амилацетат). Ерітуші өзімен бірге суды сіңіргендіктен антибиотиктің кристалданған суспензиясы пайда болады. Кристалдарды қайтара суда бикарбонат натриймен ерітеді. Одан әрі органикалық ерітінділермен экстракциялайды. Кристалды пенициллиннің шығысы 86-90% (жойылуы 10-14%) құрайды. Егер осы G пенициллиннің кристалды тұзын қоректік сорпаға қосса және оған ацилаза ферменті немесе оны түзетін бактериялар қосылса, ацилаза молекуладан жеке дара бензильді топты жойяды, нәтижесінде G пенициллин 6-аминопенициллан қышқылына ауысады (6-АПҚ). Қышқылдың антибактериялық қасиеті әлсіз, бірақ оған химиялық тәсілдермен бүйір топтарын қосып жартылай синтетикалық пенициллиндер алуға болады.
Ампициллинді алу
Бензилпенициллинді орта рН 7,0-8,0 және 40-500 С температурада Kluyvera citrophila мутантты штамы ацилазасымен гидролиздейді. Кейін биореакторға фенилглицин және басқа микроорганизмді - Pseudomonas melanogenum мутантты штамын енгізеді. Ампициллин алу үшін Ps.melanogenum ацилазасы 6-АПҚ аминтоптары ацелирленуіне ферментация жағдайын өзгерту керек, ортаның рН 5,0-5,5 дейін төмендетеді.
Ампициллин грам оңды және грам теріс бактерияларға әсер етеді, грам терістерге басым, сондықтан ішек инфекцияларында тағайындалынады; пенициллиннен айырмашылығы пероральді қолданылады.
Тетрациклин биосинтез технологиясы
Тетрациклин биосинтезінің метаболизмдік жолы малонил-СоА 8 молекуласы циклденуімен аяқталынатын бірнеше оңдаған аралас қосылыстардың пайда болуын құрайды. Бензилтиоцианатпен клеткаішілік гликолиз тежелуінде, пентозофосфатты цикл активтенуінде, ангидротетрациклиноксидаза активтенуінде антибиотиктің биосинтезі күшейеді. Ферментациялық технологияда субстрат ретінде глюкоза, жүгері қайнатпасы, аммоний фосфаты және минеральды тұздар қолданылады. Кезеңдік, тереңдік ферментация орта рН 5,8-6,0 және 280 С температурада, тұрақты аэрация мен гомогенизацияда өтеді. Тетрациклин синтезін малон қышқылының моноамиді белсендіреді. Тетрациклин синтезі фосфатпен тежелінгенінен осы ингредиенттің лимиті сақталынып отырады. Str.aureofaciens, Str.rimosus өндіруші штамдар өсіп-көбейтудің логарифмдік фазасында белсенді түрде биомассаны жоғарлатады, клетка ішінде РНҚ ұлғайяды, стрептомицеталардың гифтері қалындайды. Кейін стационарлық фазада гифтер жұқарып, РНҚ концентрациясы төмендеуінен антибиотиктердің биосинтезі жылдам жоғарлайды. Тетрациклин өнімінің клеткаішілік циклы гифтердің фрагментациялануы мен стрептомицеталар клеткаларының лизисімен аяқталынады. Дақылдық сұйықтықта антибиотиктің деңгейі 20 г/л жетеді.
Иммобилизацияланған микроорганизмдердің антибиотиктерді синтездеуі
Антибиотиктердің микробиологиялық синтезі технологиясында тағы да тасымалдаушыда иммобилизацияланған өндіруші микроорганизм қолданылады. Иммобилизация антибиотик өнімінің технологиялық циклындабекітілген штамдардың қолдануына пролонгация жасайды, дақылдық ортадағы антибиотик ерітіндісінен клеткаларды ажырату үрдісін жеңілдетеді. Ферментациялық биосинтезде тасымалдаушыда иммобилизацияланған биоөндіруші қолдануына мысалдар төменде келтірілген (кесте 16).
Микроорганизмдердің иммобилизацияланған клеткалары бір қатар антибиотиктер биосинтезі процесін атқарады. Мысалы, полиакриламидті гельде иммобилизацияланған Streptococcus lactis клеткалары низин биосинтезін жүргізеді және пайда болған антибиотиктің көлемі 30% құрайды, стрептококктың дақылында түзілгенімен салыстырғанда. Дегенмен, низин өндіруші иммобилизацияланған клеткалар антибиотик биосинтездеу қабілеті 15-20 тәулікке сақталынады, яғни иммобилизацияланған стрептококктарды көп рет қайтара қолдануға болады. Полиакриламидті гельде иммобилизацияланған Вacillus sp. клеткалары бацитрацинді синтездейді, осындай жағдайда бактериялар клеткаларының жартылай тіршілік ету кезеңі 10 тәулік. Cephalosporium acremonium иммобилизацияланған клеткалары цефалоспоринді синтездейді, Streptomyces griseus клеткалары - кандицидинді, Penicillium chrysogenum клеткалары – пенициллинді.
Кесте 16. Иммобилизацияланған микроорганизмдер технологиясымен алынған антибиотиктер
| Антибиотик | Микроорганизм | Тасмалдаүші |
| Актиномицин Д | Streptomyces parvullus | Кальцийдің альгинаты |
| Бацитрацин | Bacillus sp. | Полиакриламид |
| Даунорубицин | Str. peucetius | Кальцийдің альгинаты |
| Кандицидин | Str. griseus | k-каррагинан |
| Митрамицин | Str. iverini | Агар |
| Неомицин | Str. fradia | Целлюлозалы гранулалар |
| Окситетрациклин | Str. rimosus | Кальцийдің альгинаты |
| Пенициллин G | P. chrysogenum | k-каррагинан, цеолит |
| Рифампицин В | Str. rimosus | Стекловата |
| Тетрациклин | Str. aureofaciens | Кальцийдін альгинаты |
| Цефалоспориндер | Str. clavuligerus | Полиакриламид |
| Эритромицин | Str. erythreus | Кальцийдің альгинаты |
Фторхинолондардың химиялық синтезі
Фторхинолондардың химиялық синтезі нақты белгілі ароматты көмірсулы сақинада фтор атомдары бар негізгі заттарды қолданып және хинолон молекуласының көмірсулы қанқасын құруға негізделген. 6-фторхинолондар өндеу үшін 3-галоген-4-фторды алмастыратын анилиндер немесе 2,4-дигалоген-5-фторды алмастыратын бензой қышқылы қажет. Өндірістік жағдайда жиі нуклеофильді галогенді немесе диазотопты фторид-анионмен алмастыру реакциясы қолданылады. Кейін фторы бар анилиндерді басында этоксиметиленмалонды эфирмен конденсациялайды да Гоулд-Джекобс реакциясы бойынша пиридон циклын аяқтап молекулаішілік цикл өткізеді. Әрі қарай NH-хинолонды алкилдейді, гидролиздейді және галоген атомын 7 қатарда пиперазин қалдығына ауыстырады. Басқа технологиялық нұсқада негізгі шикі зат ретінде фторы бар бензой қышқылдар туындылары қолданылады. Осындай жағдайда маңызды интермедиат ретінде b-кетоэфир болады, әрі қарай оны орто-құмырсқа эфирімен конденсациялайды. Алынған бензоилакрилатта этокситопты амин қалдығына ауыстырады да b-амино-α–бензоил акрилатты хинолон бициклына ауыстыру үшін молекулаішілік циклді жүргізеді. 53 суретте фторхинолон қатары антибиотигі – ципрофлоксациннің молекуласы көрсетілген.
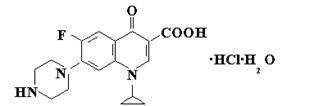
Сурет 53. Ципрофлоксацин құрылысы
Пептидті антибиотиктер
Молекулаларында пептидті байланыстары бар антимикробты қосылыстар. Химиялық құрылысы тұрғыдан бұл әртүрлі заттар топтары, көпшілігі пептидті емес текті алмастырушысы бар (майлы қышқылдар, алифатикалық аминдер мен спирттер, гидрооксиқышқылдар және қанттар мен гетероциклдер) циклды немесе бір сызықты олиго- және полипептидтерге жатады. Пептидтердің молекулалық массасы кішкентай, протеин молекуласынан айырмашылығы 30-40 Д-аминқышқылдар қалдықтардан, гетероциклды сақинасы, басқа компоненттері бар. Антимикробты активтілігі бар 800 астам пептидтер өнделген (бөлек хемокиндер, цитокиндер, нейропептидтер және т.б.).
Химиялық құрамы бойынша пептидті антибиотиктік заттардың 5 тобы ажыратылған, олардың ішінде:
- гомомерлі (грамицидин А, бацитрацин) пептидтер;
- гетеромерлі (полимиксиндер В,Е және М, блеомициндер) пептидтер;
- пептолидтер (актиномициндер, гризелицин А);
- макромолекулярлы пептидтер, күрделі кеңістіктік ұйымдастырылуы және дисульфидті көпірі бар;
- тиоэфирлі циклдар (низин, басқа лантибиотиктер).
Антимикробты пептидтер құрылымды ұйымдастырылуы бойынша бөлінеді: - бір сызықты α-спиральды пептидтер (мысалы, магаинин, меллитин, цекропин);
- нақты аминқышқылдарымен бай пептидтер, мысалы, гистидинмен немесе пролинмен;
- күрделі кеңістікті ұйымдардан тұратын дисульфидті көпірлер, тиоэфирлі циклдер және т.б. бар пептидтер. Оларға дефензиндер, протегриндер және лантибиотиктер — жоғары активті бактериялық пептидтер жатады.
Антимикробты пептидтер молекулалық массасы бойынша бөлінеді:
- лантибиотиктер, 3-7 кД молекулалық массадағы термостабильды полипептидтер;
- микроциндер, 1-2 Кд төменгі молекулалы массадағы термостабильды пептидтер;
- жоғары молекулалы термолабильді протеиндер, 10-5000 кД молекулалық массасы бар;
- протеиндер кешені, антимикробтық активтілігі көріну үшін көмірсулы немесе липидті компоненттері болуға тиісті.
Пептидті антибиотиктер клеткада бір-бірінен бір немесе бірнеше амин қышқылды қалдықтарымен немесе пептидті емес табиғатты компоненттері құрылысындағы вариацияларымен ерекшелінетін туысты қосылыстар қоспасы ретінде түзіледі. Актиномицеттер, бактериялар және саңырауқұлақтардың түрлері өндірушілер бола алады.
Пептидті антибиотиктер әртүрлі биологиялық қасиеттерге ие. Олардың грам теріс бактериялардың клетка қабырғасы (бацитрацин А) және сыртқы мембрана липопротеидтері (бицикломицин) синтезінің ингибиторлары, репликация және транскрипция (актиномицин D, блеомициндер) және протеиндер синтезі ингибиторлары (виомицин), клетка мембрана функциясының ингибиторлары (полимиксиндер, грамицидин, валиномицин), антиметаболиттер (аланозин, циклосерин). Пептидті антибиотиктер грам оңды (бацитрацин А) және грам теріс (полимиксиндер) бактерияларға, және микобактерияларға қарсы (капреомицин 1-А, виомицин) жоғары антибиотикалық активтілікке қабілетті. Кейбір пептидті антибиотиктердің өспелерге қарсы (актиномициндер) және саңырауқұлақтарға қарсы активтілігі бар; вирустарға қарсы да белсенді (дистамицин).
Эндогенді пептидтер – дефенсиндер 6-40 аминқышқылдық қалдықтардан құралған. Бұл аздаған көлемді пептидтер цистеинмен байытылған және бактериялар, саңырауқұлақтар және вирустарға қарсы активті. Адам организмінде дефенсиндерді нейтрофильді гранулоциттер, ішектің Панета клеткалары, тері клеткалары және т.б. түзеді. Көптеген антибактериялық механизмдерге қабілетті нейтрофилдерге тоқталсақ, дефенсиндер көптеген прокариоттарға жоғары тиімділік көрсететін лизосомалық-катионды протеиндердің маңызды топтар құрамына кіреді. Дефенсиндер мембранаға еніп реттелмейтін ионды каналды қалыптастырады. Сонымен қатар, дефенсиндерге бактериялық резистентілік дамымайды, себебі олардың тиімді әсері клетка мембранасының гидрофобтылы мен уникальды бактериялық фосфолипидтер құрамында, антимикробты терапияның көптеген басқа нысаналарымен салыстырғанда оларды бактериялардың өздері өзгерте алмайды.
Клеткаға антимикробты пептидтер әсер етуінің негізгі екі типін ажыратады: метаболизм процестерін тежеу немесе клетка мембранасы бүтіндігін бұзады. Микроорганизмдердің зақымдау нысанасына лиганд-рецептор, энзим немесе клеткаішілік метаболизмнің жаңа жолдарын жатқызуға болады. Мысалы, қорғаныстың тұқым қуалаған реттеуші деп аталатын 13 амин қышқылдардан құралған пептиді организмнің тінінен бөліп алынған. Осы пептид микробтық инвазияға жылдам иммунды жауапты бастап фагоциттердің активтенуімен аяқтайды.
Медициналық практикада полимиксиндер В, Е және М, кейбір өспелерге қарсы (блеомицин А, актиномицин Д) және туберкулезге қарсы (циклосерин, капреомицин 1-А, лизостафнин) пептидті препараттар қолданылады. Пептидті антибиотиктерді тағы ветеринарияда (микамицин В, нефропсин), малшаруашылығында жем қоспа ретінде (бацитрацин А, стафиломициндер), тамақ өндірісінде консервант ретінде (низин), биохимиялық ғылыми зерттеулерде (валиномицин, актиномициндер) сұранысқа ие.
Бактериялар түзетін антимикробты пептидтерді микроциндер және бактериоциндерге бөледі. Микроциндер – бұл бактерия геномында кодталған және рибосомада трансляция жолымен түзілетін төменгі молекулалы антимикробты заттар. Микроциндер кең спектрлі антагонистік активтілікпен сипатталатын микроорганизмдердің бір-бірімен бәсекеші түрде тіршілік етудің маңызды компоненті болып келеді. Зақымданған клеткаларда цитоплазмалық нысаналары бар микроциндер ерекше орын алады. Осындай микроциндердің құрылысы ерекше және цитоплазмаға ену арқылы ДНҚ-гираза, ДНҚ-тәуелді РНҚ-полимераза және аспарагин-тРНҚ-синтетаза секілді клеткаішілік нысандарға әсер етіп сезімтал клеткалар өсуін тежейді. Микроцин С (McC) – E. сoli кейбір штамдары өндіретін антибактериялық нуклеотид-гептапептид. McC басқа микроциндерге қарағанда көптеген грам теріс және грам оңды бактерияларға әсер етеді.
Бактериоциндер – бұл антибактериялық активтілігі бар және микроорганизмдерге конкуренттік басымдылық көрсететін әртүрлі спецификасы және әсер ету диапазоны бар жоғары молекулалы пептидтер.
Нақты бағытты бактериоциндер технологиялары өнделуде, биоконсервант ретінде құнды қасиеттері бар, ал келешекте бактериялардың антибиотиктерге төзімді штамдарымен күресетін белгілі бактериоциндердің модификация тәсілдері жетілдіруде.
Мысалы, бифидобактериялардың антибиотик тәрізді субстанциялары – бифидин мен бифилонг, энтеробактериялардың, вибриондардың, стрептококктардың және стафилококктардың көптеген түрлеріне антимикробтық активтілік көрсетеді. Lactobacillus acidophilus өндіретін В, F, J, M лактоциндер, ацидолин және лактоцидин белгілі, L. delbrueсkii subsp. bulgaricus - булгарицин, - L. brevis - лактобревин, L. helveticus - гельветицин, L. plantarum - лактолин немесе плантарицин, L. reuteri - реутерин. Осындай бактериоциндер бациллалардың, клостридиялардың, сахаромицеттердің, стрептококктардың, стафилококктардың, энтеробактериялардың, псевдомонадалардың, листериялардың, Candida туысты саңырауқұлақтардың өсіп-көбейюін тежейді.
Индуцирленген мутагенез технология көмегімен жақсы белгілі биоконсервант низинді өндіретін Streptococcus lactis-тің жаңа штамдары өндірілуде (патогенді және шартты-патогенді бактерияларға антимикробты кең спектрлі әсері бар лактококктардың бактериоциндері алынған).
Низин молекуласының құрамына 30 аминқышқылдар қалдықтары кіреді: лизин, гистидин, аспарагин қышқылы, серин, пролин, глицин, аланин, валин, метионин, изолейцин, лейцин, күкірті бар аминқышқылдардың сирек кездесетін қалдықтары – лантионин және b-метиллантионин, қанықпаған амин қышқылдар - дегидроаланин және b-метилдегидроаланин. Низиннің биологиялық активтілігі молекула құрамында a, b-қанықпаған аминқышқылдардың болуымен байланысты (дегидроаланин, b-метилдегидроаланин). Низиннің димерлері мен тетрамерлері, мономер секілді биологиялық активтілікке ие. Кең спектрлі антимикробты әсері бар низин тәрізді пептидтер түзетін стрептококктың жаңа штамдары селекциялануда.
Жаңа антимикробты пептидтер алынды - Serratia marcescens-тенбактериоцин 28b, лактоферрициндер және т.б.
Лактоферрин, сарысулы нәруыз көз жасынан, сілекейден, бронх шайындысынан бөліп алынды; молекулалық массасы шамамен 80 кДа, антимикробты әсері бар; темірмен байланысуынан басқа организмнің бейспецификалық қорғаныстың гуморальді факторына да жауап береді. Лактоферрициндер деп аталатын антимикробты активті қасиеті бар лактоферрин қатарынан түрлі төменгі молекулалы пептидтер бөлінген.
Дата добавления: 2015-07-14; просмотров: 4962;
