Этапы синтеза белка
Подробно синтез белка изучен у прокариот.
Белковый синтез (трансляция) может условно быть разделен на 5 стадий:
1. Активирование аминокислот.
2. Инициация трансляции.
3. Элонгация трансляции.
4. Терминация трансляции.
5. Постсинтетическая модификация белков.
Две стадии считаются подготовительными и завершающими (активирование аминокислот и постсинтетическая модификация) и три стадии составляют собственно трансляцию.
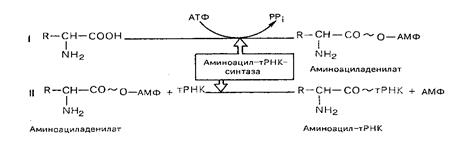
Активирование аминокислот. Необходимым условием синтеза белка является наличие не свободных, а активированных аминокислот со своим внутренним запасом энергии. Активизация свободных аминокислот осуществляется при помощи специфических ферментов – аминоацил-тРНК-синтетаз – в присутствии АТФ. Процесс протекает в две стадии.
В результате реакций образуется аминоацил-тРНК (аа-тРНК) и освобождается АМФ.
Процессы трансляции.
Инициация трансляции является началом синтеза белка и требует соблюдения ряда условий: наличия рибосом (70S – у прокариот или 80S – у эукариот), аа-тРНК, инициирующих кодонов в составе мРНК и белковых факторов инициации.
Синтез белка инициирует одна аминокислота – метионин. В кодовом словаре имеется только одна аминокислота для метионина, однако во всех живых организмах открыты две тРНК для метионина: одна используется при инициации синтеза белка, другая для включения метионина во внутреннюю структуру синтезируемого полипептида в стадии элонгации.
В прокариотических клетках происходит формилирование метионина (у эукариот нет). Формилирование имеет важный химический и биологический смысл: блокируя участие NH2 группы метионина в образовании пептидной связи, он обеспечивает тем самым синтез белка в направлении NH2 ® COOH; образовавшаяся формилметионил-тРНК, кроме того, первой связывается с определенным участком 30S субчастицы рибосомы и с мРНК.
Процесс протекает в две стадии:
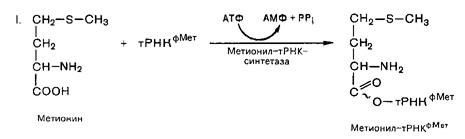
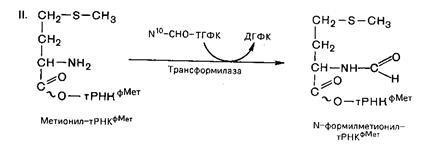
Первую стадию катализирует метил-тРНК-синтетаза, вторую – трансформилаза.
Важную роль играют белковые факторы инициации. У прокариот открыты три таких фактора: IF-1, IF-2, IF-3. Фактор IF-2 играет центральную роль в связывании инициаторной аа-тРНК. Два других фактора, вероятно, влияют на конформацию 30S субчастицы, помогая ей связываться с тРНКfmet, переносящий формилметионин.
В процессе инициации происходит присоединение 30S субчастицы к мРНК, узнавание инициирующего кодона АУГ и присоединение тРНКfmet. После образования комплекса белковые факторы инициации IF-2, IF-3 покидают 30S субчастицу, уступая место 50S субчастице, присоединение которой завершает процесс сборки полной (30S) рибосомы прокариот. Объединение субчастиц приводит к формированию двух центров связывания тРНК: Р-центра (пептидильный) и А-центра (аминоацильный) (рис. 22).
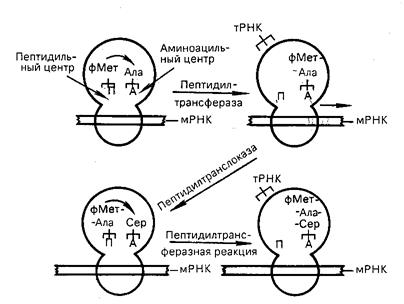
Рис. 22. Процесс элонгации полипептидной цепи
В Р-центре идет синтез пептидной связи, а А-центр предназначен для присоединения следующей аа-тРНК.
Элонгация трансляции у бактерий обслуживается тремя белковыми факторами (EF-Tu, EF-Ts, EF-G) и может быть подразделена на три стадии. На первой стадии к А-центру рибосомы присоединяется аа-тРНК, приносящая второй (после формилметионина) аминокислотный остаток, кодируемый вторым кодоном мРНК; аа-тРНК закрепляется в А-центре в комплексе с белковым фактором EF-Tu и ГТФ. При участии EF-Tu осуществляется гидролиз до ГДФ и фосфата, а выделяющаяся энергия расходуются на сближение двух акцептирующи концов молекул тРНК с прикрепленными к ним аминокислотными остатками. Комплекс EF-Tu и ГТФ при этом покидает рибосому и регенерирует с участием фактора EF-Ts,так что фактор EF-Tu вновь оказывается связанным с молекулой ГТФ, а затем и со следующей молекулой аа-тРНК.
На следующей стадии элонгации – транспептидирования – первый (формилметиониновый) остаток переносится на свободную NH2-группу второго аминокислотного остатка, связанного с тРНК, распложенного в А-центре рибосомы. В результате образуется (в А-центре) первая пептидная связь в молекуле синтезированного белка и возникает дипептидил-тРНК. тРНКfmet высвобождается в цитозоль. Р-центр остается свободным (вакантным). Третья стадия - транслокация – заключается в том, что дипептидил-тРНК перемещается из А-центра в Р-ценр рибосомы, одновременно с продвижением транслируемой мРНК через рибосому. А-центр, необходимый для связывания следующей аа-тРНК, освобождается. Транслокация идет в направлении 5/ ® 3/ и осуществляется строго на расстояние, соответствующее размеру одного триплета в мРНК. Транслокация у бактерий идет с участием фактора EF-G и сопровождается синтезом еще одной молекулы ГТФ.
Элонгация, таким образом, обеспечивает удлинение полипептидной цепи в соответствии с кодом белкового синтеза.
Терминация трансляции у бактерий связана с функционированием трех белковых факторов: RF-1, RF-2, RF-3, распознающих «бессмысленные» стоп-кодоны в мРНК. Фактор RF-1 узнает кодоны УАГ и УАА, а фактор RF-2 – кодоны УАА и УГА. Фактор RF-3 выполняет вспомогательную роль, стимулируя работу RF -1 и RF-2. При поступлении в рибосому одного из терминирующих кодонов с ним немедленно связывается соответствующий RF-фактор и тем самым блокирует присоединение аа-тРНК. Присоединение факторов терминации стимулирует пептидилтрансферазную активность в рибосоме, которая приводит к гидролизу сложноэфирной связи между С-концом синтезированного полипептида и акцептирующим концом тРНК. В результате синтезированный белок отделяется от рибосомы; одновременно отделяется тРНК и мРНК, а сама рибосома диссоциирует на 30S и 50S-субчастицы.
Постсинтетическая модификация белков. На последней стадии синтеза белка происходит формирование третичной структуры и процессинг молекулы полипептида (ассоциация мономеров с образованием олигомеров, химические превращения и т.д.).
В клетках эукариот этапы биосинтеза белка в основном соответствуют таковым у прокариот, однако представляют собой более тонко организованный процесс, связанный с особенностью организации их мРНК и иным набором белковых факторов трансляции.
Дата добавления: 2015-07-06; просмотров: 3619;
