Фізичні основи радіометрії
Явище природної радіоактивності було відкрито А. Беккерелем у 1896 році і вивчено Марією і П¢єром Кюрі, а також іншими вченими. Воно являє собою процес спонтанного розпаду ряду хімічних елементів, який супроводжується випромінюванням заряджених альфа-, бета-часток і гамма-квантів. При цьому виділяється значна енергія і утворюються нові хімічні елементи. Ці елементи самі можуть бути радіоактивними, у свою чергу розпадаючись, вони утворюють інші елементи, аж до утворення стабільного ізотопу. За такою схемою відбувається розпад найбільш розповсюджених з природних радіоактивних елементів – урану U238, U235; торію Th232. Кожен з них при розпаді утворює цілу родину хімічних елементів, які переходять один в одне, і тому отримали назву родин радіоактивних елементів: урану, актиноурану чи актинія і торію (рис. 5.1, 5.2).
Кінцевим продуктом розпаду цих родин є ізотопи природного свинцю – Pb206. У ряду урану це Pb207, у ряду актиноурану – Pb208, у ряду торію – Pb. Крім ізотопів хімічних елементів, при радіоактивному розпаді випромінюються альфа-, бета-частки і значна енергія. Скорочено розпад цих родин можна виразити як:
U238® Pb206+ 8a-часток;
U235® Pb207 + 7a-часток;
Th232® Pb208 + 6a-часток.
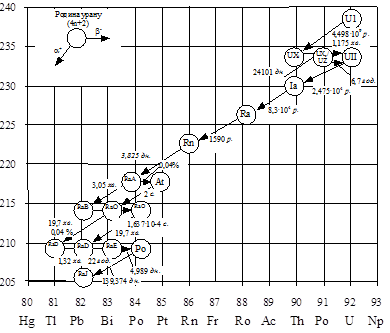
|
Рисунок 5.1 – Схема радіоактивних перетворень родини урану
Крім того, штучно були одержані ще дві родини: нептунію і плутонію. Крім радіоактивних елементів, які утворюються при розпаді родин, мають місце ще цілий ряд радіоактивних елементів, які при розпаді відразу переходять у стабільні ізотопи (К40, Ca48, Rb87, K40 і ін). З них найбільший практичний інтерес мають К40, Rb87. Вони використовуються для оцінки абсолютного геологічного віку порід і мінералів.
В радіометрії при вивченні перетворень радіоактивних елементів використовують певні закони радіоактивності. Основними з них вважаються:
- закон радіоактивного розпаду;
- закон радіоактивного накопичення;
- закон радіоактивної рівноваги;
- правило зміщення або зсуву.
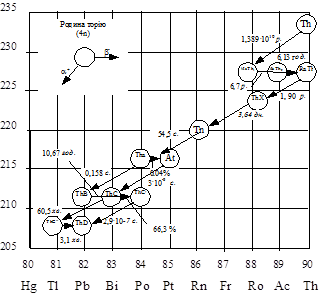
|
Рисунок 5.2 – Схема радіоактивних перетворень родини торію
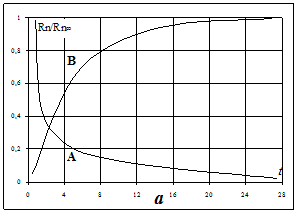
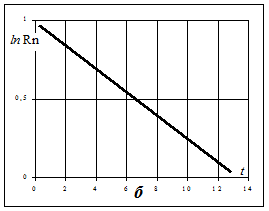
Перетворення радіоактивних елементів відбувається таким чином, що число атомів, які розпадаються (dN) в одиницю часу (dt), пропорційні наявному числу атомів (N), тобто dN=-lNdt, де l - коефіцієнт, який характеризує ймовірність розпаду атомів в одиницю часу і називається постійна розпаду. Знак “мінус” визначає незворотній характер розпаду, що визначає зменшення початкової кількості атомів. При t=0 N дорівнює початковому числу атомів No. Якщо проінтегрувати наведене вище рівняння, то отримаємо N=Noe-lt. Це є аналітичний вираз закону радіоактивного розпаду. Графічно він являє собою експоненціальну криву (на прикладі радону - рис. 5.3(а)-А). У напівлогаріфмічному масштабі і системі координат - t, lnN отримаємо пряму з кутовим коефіцієнтом (рис. 5.3(б)):
lnN=lnNo-lt.
Значення lN характеризує швидкість радіоактивного розпаду, або активність:
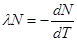 .
.
|
|
Рисунок 5.3 – Характеристика процесів розпаду і накопичення радону
а – розпад (а) радону; Rn – кількість радону у момент часу t; Rn¥ - рівноважна кількість радону; б – розпад радону (напівлогарифмічний масштаб)
Якщо t=T, або час протягом якого розпадається половина визначального числа атомів радіоактивного елемента (N= 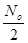 ), то після логарифмування отримаємо
), то після логарифмування отримаємо
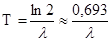 ,
,
де Т – період напіврозпаду радіоактивного елемента. Крім констант  і Т в радіометрії використовується ще одна характеристика – час життя ядра атома -t. Між цими константами існує залежність:
і Т в радіометрії використовується ще одна характеристика – час життя ядра атома -t. Між цими константами існує залежність:
t= 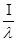 ; Т = 0,693t.
; Т = 0,693t.
Використовуючи ці залежності можливо за знанням будь-якої з них знайти останні.
При розпаді радіоактивного елемента утворюється новий елемент, кількість якого буде зростати згідно рівняння: N=No(1–е-lt). Воно є аналітичним виразом закону радіоактивного накопичення.Графічно воно також являє собою експоненціальну криву(рис. 5.3 (а - в)). Якщо накопичення нового елемента за рахунок розпаду материнського перевищує період напіврозпаду дочірніх елементів, то через певний час між числом атомів, які розпадаються і які накопичуються встановлюється рівновага – стан, при якому число атомів, які розпадаються буде дорівнювати числу атомів які накопичуються. Математично цей стан може бути визначений виразом:
lмNм = lдNд,
або якщо ми маємо справу із цілою родиною радіоактивних елементів:
liNi = l2N2 = ..... = lnNn.
В цьому виразі показаний стан стійкої радіоактивної рівноваги.
При t>10T материнського елемента 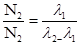 , що відповідає стану, при якому співвідношення радіоактивних елементів прагне до певного постійного значення, що фіксує умову рухомої радіоактивної рівноваги.
, що відповідає стану, при якому співвідношення радіоактивних елементів прагне до певного постійного значення, що фіксує умову рухомої радіоактивної рівноваги.
При стійкій рівновазі, коли l1<<l2, 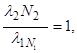 або
або 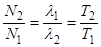 . Це дозволяє за вмістом або за константами розпаду одного із елементів встановлювати вміст, або константи іншого, що досить широко використовується у практиці радіометричних досліджень. Наприклад, з врахуванням періодів напіврозпаду між ураном (Т=4,5×109 років) і радієм (Т»1590 років) у стані радіоактивної рівноваги, яка відбувається між ними через час близький до 16000 років, відношення їх атомів буде дорівнювати
. Це дозволяє за вмістом або за константами розпаду одного із елементів встановлювати вміст, або константи іншого, що досить широко використовується у практиці радіометричних досліджень. Наприклад, з врахуванням періодів напіврозпаду між ураном (Т=4,5×109 років) і радієм (Т»1590 років) у стані радіоактивної рівноваги, яка відбувається між ними через час близький до 16000 років, відношення їх атомів буде дорівнювати 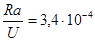 . Приймаючи це до уваги, можливо визначити стан радіоактивної рівноваги між ураном і радієм у будь якій геологічній обстановці, що є важливим при виборі методів виконання радіометричних робіт і інтерпретації радіометричних даних. Для цього незалежними засобами оцінюється вміст цих елементів і визначається величина коефіцієнту рівноваги:
. Приймаючи це до уваги, можливо визначити стан радіоактивної рівноваги між ураном і радієм у будь якій геологічній обстановці, що є важливим при виборі методів виконання радіометричних робіт і інтерпретації радіометричних даних. Для цього незалежними засобами оцінюється вміст цих елементів і визначається величина коефіцієнту рівноваги: 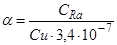 .
.
При a>1 рівновага зміщена у бік надлишку Ra, при a<1 у бік U.
Розпад радіоактивних елементів супроводжується випромінюванням заряджених часток. При цьому утворюються нові хімічні елементи згідноправила здвигу (зміщення) Ф. Содді і К. Фаянса. У відповідності з цим правилом, мають місце два типи перетворень природних радіоактивних елементів:
1) якщо хімічний елемент з атомним номером Z і атомною вагою А розпадається із випромінюванням a-частки, то утворюються новий хімічний елемент з атомним номером Z-2 і атомною вагою А-4;
2) якщо розпад елемента відбувається з випромінюванням бета-частки, то утворюється новий хімічний елемент з атомним номером Z+1 з тією ж атомною вагою. Ці нові хімічні елементи є ізотопами відповідних (згідно з новими атомними номерами) хімічних елементів таблиці Менделєєва.
Крім наведених перетворень природних радіоактивних елементів можливо привести також ще декілька: позитронний розпад, електронне захоплення, ізомерний перехід, спонтанний розпад.
Позитронний розпад відбувається з випромінюванням позитрона (b+), унаслідок чого утворюється новий хімічний елемент з атомним номером Z-1 з тією ж атомною вагою.
Електронний захват - процес захоплення електрона із електронних орбіт К або L атомів деяких елементів. При цьому утворюється новий хімічний елемент з атомним номером Z-1 без зміни атомної ваги. При електронних перетвореннях атомів, як правило, має місце утворення деякої надлишкової енергії, яка супроводжує ці перетворення у вигляді нейтрально заряджених часток з нульовою масою – нейтрино (n).
Крім того, частина енергії може випромінюватися завдяки так званих ізомерних переходів ядер атомів з одного енергетичного стану в інший.
У деяких важких ядер (U235, Th232, Pu239) спостерігається спонтанний розпад на дві частини із різною масою. При цьому випромінюється декілька нейтронів і інших ядерних часток, а також звільнюється велика надлишкова енергія розпаду.
Дата добавления: 2015-06-27; просмотров: 1492;
