Вторичная структура белка двояка
Вторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей. Различают два вида таких структур - укладка белка в виде каната и и в виде гармошки.
Формирование вторичной структуры вызвано стремлением пептида принять конформацию с наибольшим количеством связей между пептидными группами. Тип вторичной структуры зависит от устойчивости пептидной связи, подвижности связи между центральным атомом углерода и углеродом пептидной группы, размером аминокислотного радикала.
Все указанное вкупе с аминокислотной последовательностью впоследствии приведет к строго определенной конфигурации белка.
Можно выделить два возможных варианта вторичной структуры: α-спираль (α-структура) и β-складчатый слой (β-структура). В одном белке, как правило, присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
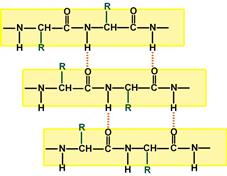
Вторичная структура образуется только при участии водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода второй, одновременно кислород второй пептидной группы связывается с водородом третьей и т.д.
| 
|
| Участие водородных связей в формировании вторичной структуры | Укладка белка в виде α-спирали |
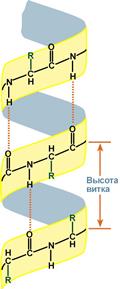
α-Спираль
Данная структура является правозакрученной спиралью, образуется при помощи водородныхсвязей между пептидными группами 1-го и 4-го, 4-го и 7-го, 7-го и 10-го и так далее аминокислотных остатков.
Формированию спирали препятствуют пролин и гидроксипролин, которые из-за своей структуры обуславливают "перелом" цепи, ее резкий изгиб.
Высота витка спирали составляет 0,54 нм и соответствует 3,6 аминокислотных остатков, 5 полных витков соответствуют 18 аминокислотам и занимают 2,7 нм.
β-Складчатый слой
В этом способе укладки белковая молекула лежит "змейкой", удаленные отрезки цепи оказываются поблизости друг от друга. В результате пептидные группы ранее удаленных аминокислот белковой цепи способны взаимодействовать при помощи водородных связей.
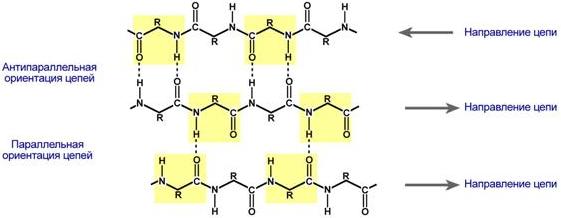
Укладка белка в виде β-складчатого слоя
Ориентация реагирующих участков может быть параллельна(когда соседние цепи идут в одном направлении) или антипараллельна (цепи идут в противоположном направлении). Таких взаимодействующих друг с другом участков одного белка может быть от двух до пяти.
Дата добавления: 2015-06-27; просмотров: 1319;
