Химические свойства лития, рубидия и цезия, а также их важнейших химических соединений
МЕТАЛЛУРГИЯ ЛИТИЯ, РУБУДИЯ И ЦЕЗИЯ
История открытия лития, рубидия и цезия
Литий был открыт в 1817 г. А. Арфведсоном (Швеция) в минерале петалите, а вскоре был обнаружен и в других минералах (лепидолит, сподумен). В 1825 г. И. Берцелиус обнаружил литий в воде минеральных источников. Металлический литий впервые получил Г. Дэви в 1818 г. Электролитическим восстановлением оксида лития. Макроколичества металлического лития были получены Р. Бунзеном и А. Матиссеном в 1854 г. при электролизе расплава хлорида лития.
Свое название литий получил от греческого слова λίϑοζ, означающего камень.
Рубидий и цезий были открыты Р. Бунзеном и Г. Кирхгофом при изучении спектров минерального сырья. Первым в 1860 г. они открыли цезий в спектрах солей щелочных металлов, выделенных из минеральной воды. Год спустя, они открыли рубидий в спектрах хлороплатинатов, полученных из раствора разложения лепидолита.
Металлический рубидий впервые выделил Р. Бунзен восстановлением гидротартрата рубидия углеродом. Металлический цезий в 1882 г. впервые получил К. Сеттерберг электролизом расплава цианидов цезия и бария.
Название рубидий и цезий получили в соответствии с латинскими наименованиями цветов наиболее ярких линий спектра: rubidius — темно-красный, caesius — небесно-голубой.
Химические свойства лития, рубидия и цезия, а также их важнейших химических соединений
Сходство химических свойств лития, рубидия, цезия (а также остальных щелочных металлов) определяется практически идентичным строением внешней электронной оболочки этих металлов. Их отдельные важные химические и физико-химические свойства представлены в таблице 2.1.
Обладая низкими потенциалами ионизации, щелочные металлы (М) легко переходят в степень окисления М(I). Ионизация вторых электронов требует на порядок больше энергии, поэтому другие степени окисления щелочных металлов не известны. С увеличением заряда ядра элементов в группе наблюдается усиление их металлических свойств и реакционоспособности.
Из-за малых размеров атома лития его кристаллическая решетка обладает наибольшей прочностью, отсюда самые высокие в ряду щелочных металлов температуры плавления и кипения, а также большая твердость.
Отрицательный сдвиг электродных потенциалов (расплав) иллюстрирует увеличение реакционной способности в ряду Li–Cs. Для водных растворов аномально отрицательный потенциал лития обусловлен большим вкладом гидратации в стабилизацию окисленной формы.
Таблица 2.1 — Свойства щелочных металлов.
| Свойства металлов и их ионов | Li | Na | К | Rb | Cs |
| Атомный номер | |||||
| Атомная масса, г/моль | 6,94 | 22,99 | 39,10 | 85,47 | 132,91 |
| Плотность, г/см3 | 0,53 | 0,97 | 0,86 | 1,53 | 1,90 |
| Температура плавления, °С | 180,6 | 97,8 | 63,7 | 39,5 | 28,4 |
| Температура кипения, °С | |||||
| Удельная теплоемкость (20°С), Дж/(г·К) | 3,39 | 1,20 | 0,74 | 0,33 | 0,21 |
| Энергия ионизации (J1), эВ: | 5,39 | 5,18 | 4,35 | 4,15 | 3,96 |
| Энергия ионизации (J2), эВ: | 75,66 | 47,26 | 31,60 | 27,26 | 23,11 |
| Работа выхода электрона, эВ | 2,36 | 2,33 | 2,26 | 2,13 | 1,93 |
| Атомный радиуc, нм | 0,155 | 0,189 | 0,236 | 0,248 | 0,268 |
| Ионный радиус (к.ч.6), нм | 0,076 | 0,102 | 0,138 | 0,152 | 0,167 |
| Радиус гидратированного иона, нм | 0,340 | 0,276 | 0,232 | 0,228 | 0,229 |
| Ионный потенциал, нм-1 | 9,8 | 7,2 | 6,6 | 5,9 | |
| Гидратное число иона | 25,3 | 16,6 | 10,5 | 10,0 | 9,9 |
| Энтальпия гидратации, кДж/моль | |||||
| Электродный потенциал (расплав), В | –2,10 | –2,43 | –2,61 | –2,74 | –2,91 |
| Электродный потенциал (водн. р–р), В | –3,05 | –2,71 | –2,92 | –2,93 | –2,92 |
| Эффективное сечение захвата тепловых нейтронов, барн (10-28 м2) | 3,7 |
Изменение реакционной способности в ряду щелочных элементов можно проследить на многих реакциях:
– возрастает скорость взаимодействия металлов с водой:
2M + 2H2O → 2MOH + H2
в обычных условиях литий реагирует медленно; натрий — бурно; калий воспламеняется, а рубидий и цезий реагируют со взрывом.
– уменьшается температура необходимая для гидрирования металлов и термическая устойчивость полученных гидридов:
2M + H2 → 2MH.
Для лития температурный диапазон гидрирования составляет 400–600°С, а для остальных щелочных металлов — 350–400°С.
– на воздухе все компактные щелочные металлы горят на воздухе и в кислороде, образуя оксиды и пероксиды:
4M + O2 → 2M2O
2M + O2 → M2O2
M + O2 → MO2.
При этом литий образует только оксид (Li2O) со следами неустойчивого пероксида (Li2O2); натрий дает пероксид (Na2O2), а при нагревании под давлением кислорода неустойчивый надпероксид (NaO2). Калий, рубидий и цезий образуют на воздухе пероксиды (M2O2), в кислороде — надпероксиды (MO2), а оксиды получаются только при недостатке кислорода.
– в ряду Li–Cs возрастает устойчивость и способность металлов образовывать соединения с крупными анионами (анионными комплексами), куда они входят обычно в качестве внешнесферных катионов.
Среди щелочных металлов малые размеры атома и иона лития определяют ряд его свойств, отличающий от других членов группы и сближающих с магнием (диагональное сходство):
– благодаря малому размеру и высокой поляризующей способности, ион лития в одном растворе сильно гидратирован;
– разница в величинах ионных радиусов лития и натрия значительно больше, чем лития и магния, поэтому взаимное изоморфное замещение в первой паре встречается редко, а второй — часто;
– в отличие от всех щелочных элементов (но подобно магнию) литий непосредственно реагирует с азотом, образуя нитрид при комнатной температуре;
– растворимость гидроксида, фторида, фосфата и карбоната лития в отличие от аналогичных солей других щелочных металлов (но подобно магнию) очень мала
– реакции термического разложения некоторых солей лития (например, карбоната) протекают при относительно невысоких температурах, когда аналогичные соли других щелочных металлов устойчивы.
Для технологии и применения важны следующие соединения лития.
Гидроксид лития является наименее растворимым в воде по сравнению с остальными щелочными металлами (таблица 2.2, рисунок 2.1) Из водных растворов гидроксида лития кристаллизуется моногидрат LiOH·Н2О, который теряет кристаллизационную воду только при температуре выше 600°С. При обычной температуре гидроксид лития и его концентрированные растворы разрушают стекло и фарфор, его можно хранить в парафинированных или фторопластовых сосудах. В расплавленном состоянии он разрушает все металлы, кроме Au, Ag и Ni
Сульфат лития наиболее устойчивая его соль лития, хорошо растворяется в воде, при температуре выше 0°С имеет отрицательный коэффициент растворимости (рисунок 2.1). Из водных растворов в широком интервале температур выделяется в виде моногидрата Li2SO4·Н2О, который можно обезводить при ~500°С.
Нитрат лития очень гигроскопичен, хорошо растворяется в воде, растворимость увеличивается с повышением температуры, образует пересыщенные растворы. В водном растворе сильно диссоциирован, при температуре ниже 30°С кристаллизуется LiNO3·3Н2О, при более высокой — безводный LiNO3 (рисунок 2.1).
Таблица 2.2 — Свойства гидроксидов щелочных металлов
| Гидроксид | Температура, °С | Плотность, г/см3 | Растворимость (15°C), моль/л | ∆H298,f, кДж/моль | |
| плавления | кипения | ||||
| LiOH | 2,54 | 5,3 | –69,0 | ||
| NaOH | 2,13 | 26,4 | –100,4 | ||
| КОН | 2,12 | 19,1 | –121,3 | ||
| RbOH | 3,20 | 17,9 | –117,2 | ||
| CsOH | 3,68 | 25,8 | –113,0 |
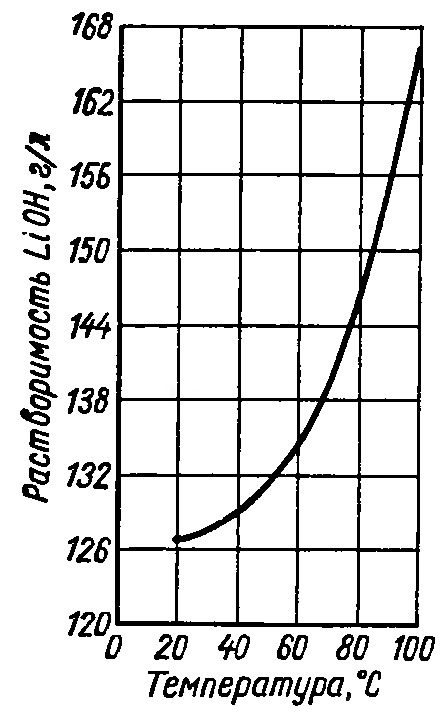
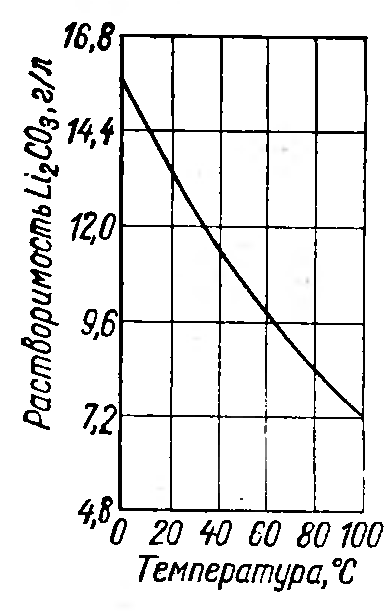
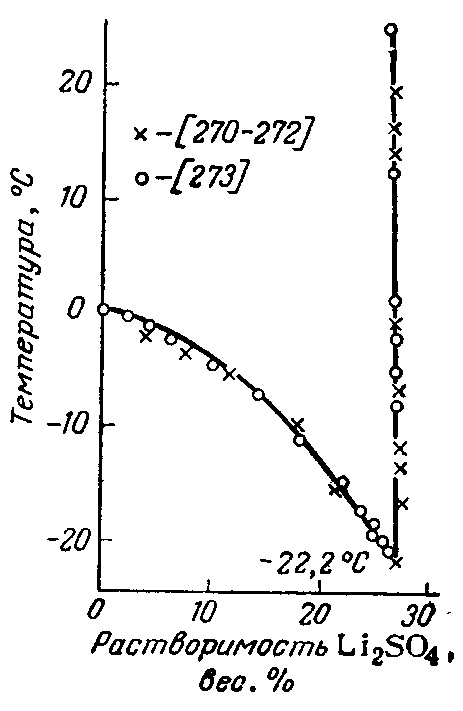
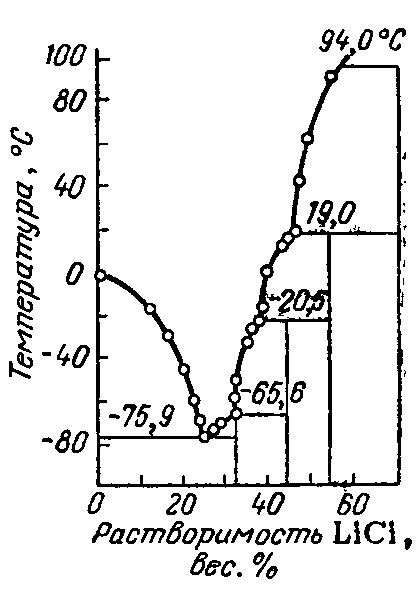

Рисунок 2.1 — Политермы растворимости в воде наиболее распространенных соединений лития.
Фторид лития не гигроскопичен, в воде растворяется плохо, при 25°С его растворимость составляет ~1,1 г/л. Из водного раствора кристаллизуется в виде безводной соли. Растворимость LiF понижается в присутствии аммиака и особенно фторида аммония, в азотной и серной кислотах растворяется при комнатной температуре.
Хлорид лития — бесцветное кристаллическое вещество, сильно гигроскопичен, на воздухе расплывается сильнее хлорида кальция, хорошо растворяется в воде, при повышении температуры растворимость увеличивается (рисунок 2.1). LiCl является сильным высаливателем и дегидратирующим агентом.
Фосфат лития — одна из наименее растворимых его солей: 0°С растворимость составляет ~ 0,22 г/л, а при 18 °С ~0,34 г/л. Из водных растворов при обычной температуре осаждается Li3PO4·2Н2О. При действии на него избытка фосфорной кислоты, сильных кислот (соляной или азотной) происходит образование кислых солей Li2НPO4 и LiН2PO4.
Малая растворимость фосфата лития используется в технологии для его доизвлечения лития после, например, осаждения карбоната. Так как сам фосфат лития не имеет самостоятельного применения, то его перерабатывают на гидроксид обработкой оксидом кальция (известью) в водном растворе или на LiCl в расплаве при 850°С обработкой хлоридом кальция:
2Li3PO4 + ЗСа(ОН)2 → Са3(РО4)2 + LiOH;
2Li3PO4 + 3CaCl2 → Са3(РО4)2 + LiCl.
Карбонат лития термически неустойчивое соединение, плавится при 732°С, но уже при этой температуре становится заметной его термическая диссоциация:
Li2CO3 → Li2O + CO2.
Давление СО2 становится равным атмосферному при 1270°С
Карбонат — одна из малорастворимых солей лития, выделяется в осадок в виде безводной соли (рисунок 2.1). Он не образует двойных или комплексных соединений с карбонатами щелочных металлов, поэтому при добавлении в раствор их избытка вследствие высаливающего действия одноименного иона растворимость карбоната лития уменьшается.
Для технологии и применения важны следующие соединения рубидия и цезия.
Гидроксиды рубидия и цезия — бесцветные кристаллические вещества, хорошо растворимые в воде (таблица 2.2). Температурный коэффициент растворимости отрицательный. Это очень активные в химическом отношении вещества, сильнейшие основания,. На воздухе расплываются и карбонизуются. Гидроксиды рубидия и цезия и их концентрированные растворы при обычной температуре разрушают стекло; расплавы разрушают железо, кобальт, никель, платину, корунд и диоксид циркония, постепенно растворяют даже серебро и золото. Устойчив против действия МОН только родий и его сплавы.
Для получения гидроксидов рубидия и цезия обычно используют обменные реакции в водном растворе сульфатов, карбонатов, квасцов с гидрооксидом бария:
M2SО4 + Ba(OH)2 → 2MOH + BaSО4.
Сульфаты рубидия и цезия хорошо растворимы в воде. Интерес к ним обусловлен тем, что с сульфатами металлов в степени окисления (II) и (III) они образуют многочисленные двойные соединения. Из них наиболее интересными с точки зрения технологии являются квасцы — двойные сульфаты с общей формулой MeM(SO4)2·12Н2O, где Мe — Rb или Cs; М — Al, Ga, In, V, Мn, Fe, Со.
Они представляют большой интерес для технологических процессов концентрирования, первичного разделения этих элементов и отделения от калия, поскольку растворимость квасцов рубидия и цезия в воде незначительна и уменьшается от калия к цезию. При этом алюмоцезиевые квасцы имеют наименьшую растворимость среди известных квасцов (рисунок 2.2).
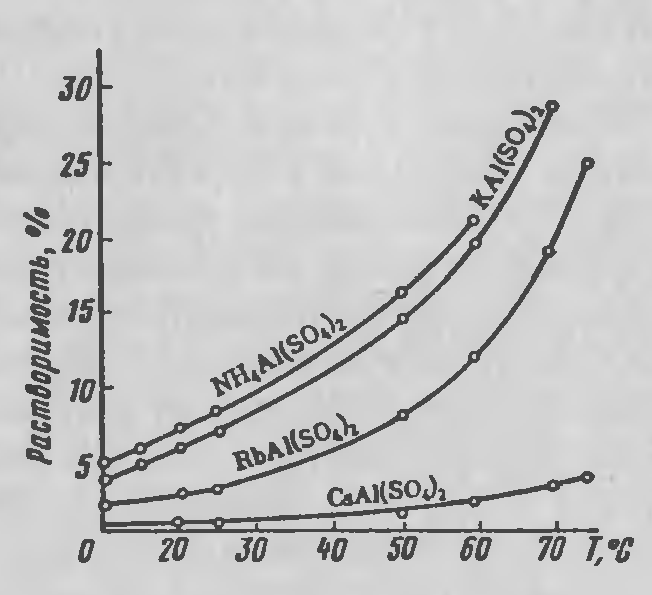
Рисунок 2.2 — Политермы растворимости в воде алюмоквасцов щелочных металлов и аммония.
Алюморубидиевые и алюмоцезиевые квасцы образуются при взаимодействии водных слабокислых растворов сульфатов рубидия и цезия с сульфатом алюминия. Для перевода квасцов в простые соединения рубидия и цезия используется взаимодействие их с гидроксидом бария:
MeAl(SO4)2·12Н2O + 2Ba(OH)2 → MeOH + Al(OH)3 + 2BaSO4 + 12H2O.
Хлориды рубидия и цезия — выделяются из водных растворов в виде негигроскопичных безводных кристаллов, хорошо растворяющихся в воде; температурный коэффициент растворимости положительный (рисунок 2.3). Значительное увеличение растворимости с температурой в отличие от NaCl благоприятствует отделению натрия от хлоридов рубидия и цезия.
Хлориды рубидия и цезия образуют многочисленные двойные соединения с хлоридами многих элементов. Их них наибольший интерес представляет карналлит: Rb(Cs)Cl· MgCl2·6Н2О — соединение, в форме которого рубидий и цезий как изоморфные примеси находятся в природе в калиевом минерале карналлите. Этот минерал широко используется для получения магния и солей калия. Рубидиевый и цезиевый карналлиты — малорастворимые соединения, причем цезиевый карналлит более растворим, чем рубидиевый (рисунок 2.4).
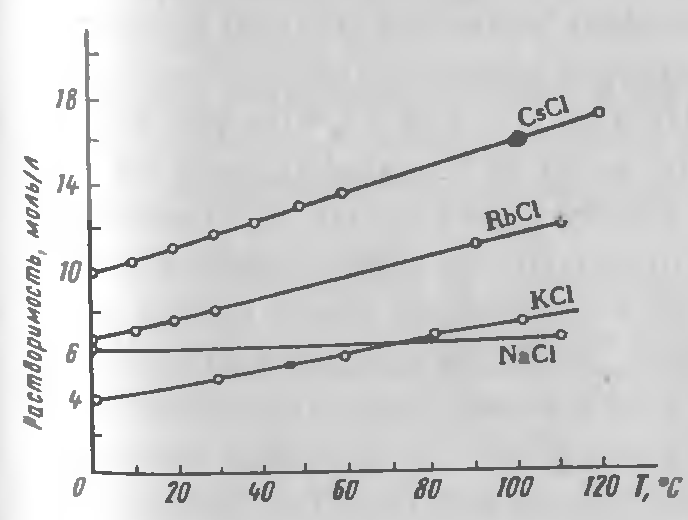
Рисунок 2.3 — Политермы растворимости в воде алюмоквасцов щелочных металлов и аммония.
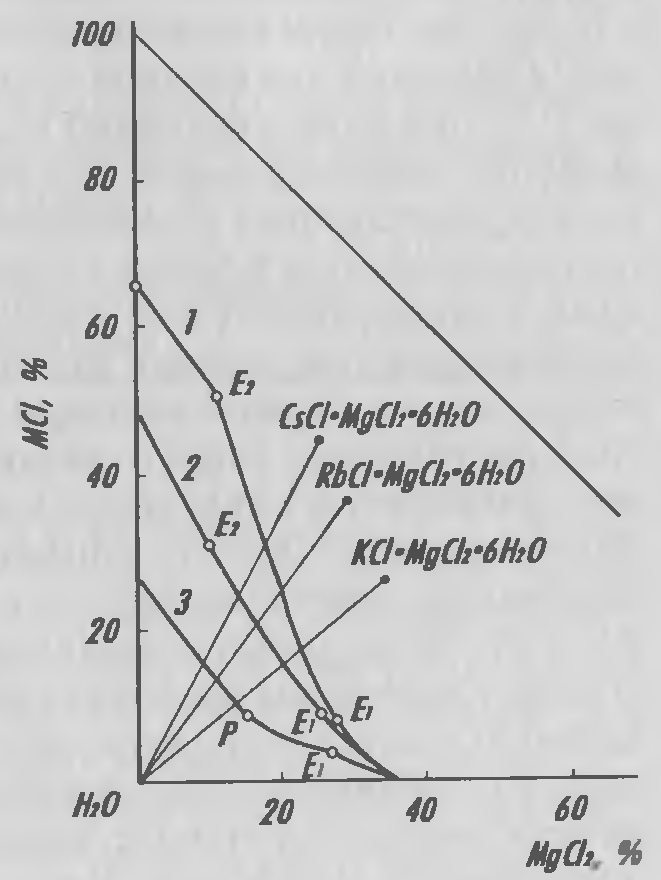
Рисунок 2.4 — Изотермы растворимости в системе MCl — MgCl2 — H2O; M соответствует 1– Cs; 2– Rb; 3– K (25°С).
Природный калиевый карналит растворяется водой с образованием КС1 и обогащенного рубидием и цезием искусственного карналита. Многократное разложение искусственного карналита позволяет получать продукты перекристаллизации обогащенные рубидием и цезием.
Особенностью органических производных рубидия и цезия является значительная растворимость их средних солей многих органических кислот при малой растворимости соответствующих им кислых солей. В связи с этим кислые соли органических кислот (гидрооксалаты, гидротартраты) используются для выделения рубидия и цезия из растворов. Достоинство этих соединений заключается в том, что от них достаточно легко перейти к карбонатам рубидия и цезия в результате термического разложения.
Гидрооксалаты МН3(С2O4)2 — бесцветные кристаллические вещества, из раствора выделяются в виде дигидратов. Растворимость гидрооксалатов калия, рубидия и цезия при 21°С, соответственно, близка к 24,6; 30,3 и 43,4 г/л. Гидрооксалаты переходят в нормальные оксалаты в интервале 240–245°С, выше 450°С образуются карбонаты:
2МН3(С2O4)2 ·2H2O → М2СО3 + 4СО+ЗСО2 + 7Н2O.
Гидрооксалаты часто используют как промежуточный продукт в процессах очистки различных соединений рубидия и цезия. Для их осаждения в нагретый раствор соли рубидия или цезия добавляют твердую щавелевую кислоту из расчета, чтобы после выделения осадка раствор был насыщен ею.
Гидротартраты рубидия и цезия МНС4Н4О6 — наименее растворимые соли винной кислоты; растворимость гидротартратов калия, рубидия и цезия при 25°С близки к 6,45; 11,8 и 96,6 г/л, соответственно. В то же время растворимость среднего тартрата рубидия в этих же условиях составляет ~66 %. Соединения выше 500°С разлагаются с образованием соответствующих карбонатов.
Галогенметаллатные соединения. Галогениды щелочных металлов входят в состав большого числа комплексных соединений, в которых в комплексном анионе лигандами являются кислотные остатки исходных солей (галогены). Наиболее устойчивыми соединениями такого рода являются ацидогалоидные соединения рубидия и цезия. Термическая устойчивость ацидогаллоидных соединений обычно возрастает от лития к цезию, а растворимость уменьшается; исключение составляют фториды, у которых растворимость меняется в обратном направлении.
Гексахлоростаннаты M2[SnCl6] — бесцветные мелкокристаллические вещества, растворимость которых при 20°С составляет ~44 г/л для цезия; 100 г/л для рубидия и 640 г/л для калия. В то же время в смеси спирта с соляной кислотой растворимость Cs2[SnCl6] и Rb2[SnCl6] резко падает и становится ничтожной. Для получения M2[SnCl6] используют реакции между МС1 и SnCl4 в солянокислом растворе.
Гексахлороплюмбаты M2[PbCl6] — желтые мелкокристаллические вещества, устойчивые только в солянокислом растворе, содержащем не менее 20 % НCl, мало растворимые в соляной кислоте и гидролизующиеся в водном растворе. Гексахлороплюмбаты рубидия и цезия, в отличие от калия, не разлагаются разбавленной соляной кислотой и 96 %-ным этанолом; это позволяет осуществить предварительное отделение рубидия и цезия от остальных щелочных элементов, в том числе и калия.
Эннеахлородистибиат цезия Сs3[Sb2Cl9] — бледно-желтое мелкокристаллическое вещество гидролизующееся в воде и растворах аммиака:
Сs3[Sb2Cl9] + 2Н2O → 2SbOCl + 3CsCl + 4НС1,
Сs3[Sb2Cl9] + 6NH4OH → Sb2O3 + 3CsCl + 6NН4С1 + 3Н2O.
В результате гидролитического разложения и отделения осадка соединений сурьмы получают чистые растворы хлорида цезия. Растворимость Сs3[Sb2Cl9] в соляной кислоте мала и незначительно меняется с изменением концентрации кислоты. Соединение образуется при взаимодействии растворов CsCl и твердого SbCl3 или его солянокислого раствора.
Цианометаллатные соединения. Цианиды рубидия и цезия с солями некоторых металлов образуют комплексные соединения типа Mе4[M(CN)6] и Mе2[M(CN)4], где Ме — Rb, Cs; М — Zn, Ni, Со, Си, Fe(II). Практическое значение среди этой группы соединений имеют гексацианоферраты. Гексацианоферраты щелочных металлов склонны к образованию смешанных соединений с металлами в степени окисления (II) и (III) типа Me2M[Fe(CN)6], Me2M3[Fe(CN)6]2, Me4M4[Fe(CN)6]3, MeM[Fe(CN)6].
Практический интерес из-за их незначительной растворимости представляют смешанные гексацианоферраты рубидия и цезия с магнием и кальцием. Растворимость в воде при 25°С Rb12Mg8[Fe(CN)6]7 ·12Н2О составляет ~0,22 г/л; а аналогичной соли цезия 0,10 г/л. Растворимость Me2Ca[Fe(CN)6]·nH2O в тех же условиях: соединения рубидия 0,18; цезия 0,038 г/л. Такая низкая растворимость может быть использована как в технологических, так и в аналитических целях. Наименее растворимы среди этой группы соединений смешанные гексацианоферраты рубидия и цезия с никелем. Для получения смешанных гексацианоферратов используют взаимодействие гексацианоферратов магния или щелочноземельных элементов с солями рубидия или цезия в растворе.
Дата добавления: 2015-06-22; просмотров: 5425;
