ГАЗЫ В СТАЛИ
В любой стали в некоторых количествах содержатся элементы, в обычных условиях являющиеся газами. К ним в первую очередь относятся кислород, азот и водород, в значительной степени влияющие на качество стали. Процесс, в результате которого газы оказываются в металле в атомарном, ионном состоянии или в виде химических соединений, в металлургической практике обычно называют процессом растворения газов в металле. Условно в этом процессе можно выделить несколько стадий: 1) массоперенос газа к поверхности металла; 2) адсорбция газа на поверхности металла; 3) переход через границу газ—металл; 4) диффузия газа в тонком неперемешиваемом (диффузионном) слое жидкости; 5) массоперенос в толщу металла.
Лимитирующей стадией процесса растворения газов в металле, как правило, является либо внешняя диффузия (подвод газа), либо внутренняя диффузия (массоперенос в металле). Иногда лимитирующим является ад-сорбционно-кинетическое звено (адсорбция на поверхности и переход через граничный слой). Чаще лимитирует процесс растворения газов внутри-диффузионная составляющая, однако кроме железа и растворяющегося газа в металле всегда содержится большее или меньшее количество примесей. Если поверхностная активность третьего компонента достаточна, он может существенно влиять на интенсивность перехода газа через границу газ—металл. Обычно под растворимостью газа понимают его количество, перешедшее в раствор в металле при нормальном парциальном давлении газа. Растворимость газов в металле сильно зависит от температуры. В соответствии с уравнением изобары Вант-Гоффа зависимость растворимости газа sot температуры может определяться следующим уравнением:
S= Сехр(-ΔH5/2RT),
где С—постоянная интегрированная; ΔH 5 — изменение энтальпии при растворении и образовании раствора данного газа; R — универсальная газовая постоянная; T—температура.
С учетом логарифмической формы этого уравнения
lnS=lnC-bHs/2RT= =C-bHs/2RT*1/T
изменение растворимости газов графически удобно представлять в координатах InS— (1/T). В прямоугольных координатах зависимость InS от 1/Т обычно представляет собой прямую линию. В общем случае ΔHS одновременно зависит от изменения: 1) энтальпии диссоциации этого газа у поверхности металла ΔH дис; 2) энтальпии растворения ΔH раст; 3) энтальпии взаимодействия, которое может иметь место между растворяющимся газом и растворенными в железе примесями ΔH В3. В результате ∑ ΔH S= ΔH дис + ΔH раст+ ΔH В3
В зависимости от суммарного (результирующего) изменения энтальпии ДЯ5 растворимость газов повышается или понижается с повышением температуры металла (рис. 12.1). В случае растворения в чистом железе двухатомных газов установлена четкая связь между парциальным давлением р этих газов в атмосфере над распла вом и растворимостью газа в металле: S=K 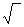 p.
p.
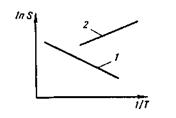
Рис. 12.1.Влияние температуры на растворимость газов S:
1 — увеличение растворимости; 2— уменьшение растворимости
Это соотношение называют законом квадратного корня или законом Сивертса (по имени ученого, установившего это соотношение). Согласно этому закону в процессе растворения двухатомные молекулы диссоциируют на атомы, например H2(г) → 2[Н], при этом константа равновесия
Кн=[Н]2/рН2, [Н]= 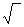 КНрН 2 = К`
КНрН 2 = К` 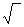 рН 2 .
рН 2 .
Для реакции
N2(г) → 2[H]
КN=[N]2/PN2, [N]=К" 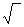 p N2.
p N2.
Если при растворении водорода или азота в металле образуются соединения, содержащие более одного атома газа (например, ZrH2, TiH2, Si3N4 и т. п.), то закон квадратного корня недействителен. Однако такие случаи являются исключением; они чаще всего имеют место в конце плавки, после того как в металл вводят такие добавки, как цирконий, титан и др. Обычно по ходу плавки металл не содержит значительного количества гидридо- или нитридообразующих примесей; в заметных количествах содержится лишь углерод, а для железоуглеродистого расплава закон квадратного корня по водороду и азоту выполняется. В тех случаях, когда растворы газов в сплавах далеки от идеальных и связи между растворяющимися газами и железом и его примесями настолько сильны, что образуются достаточно прочные соединения (гидриды, нитриды, оксиды), соединения эти имеют общее название неметаллические

Рис. 12.2.Изменение растворимости (поглощения) газов в металле при образовании раствора (1) и химического соединения (2)
включения. Характер зависимости растворимости от давления газа Sr=f(pr) различен в случаях образования раствора, близкого к идеальному, или химического соединения. При образовании соединения на кривой растворимости Sr — pr наблюдается перелом (рис. 12.2).
Дата добавления: 2015-06-22; просмотров: 757;
